研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)  2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
(2)还可以用活性炭还原法处理氮氧化物,反应为:C(s)+2NO(g)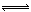 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.050 |
0.025 |
0.025 |
| 30 |
0.050 |
0.025 |
0.025 |
| 40 |
0.036 |
0.032 |
0.010 |
| 50 |
0.036 |
0.032 |
0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
量取20.00mL待测液所用的仪器是_______________________;
选用的指示剂为。
下面是某学生实验的一次数据,请完成计算
| 坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
| 11.721g |
22.692g |
18.631g |
X=__________________;(精确到0.01)
实验相对误差是_________________。(保留小数点后一位)
“恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(本题共10分)
测定硫酸铜晶体(CuSO4∙XH2O )中X值的实验过程如下:
41.下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
“镁带中镁的质量分数测定”中,读取量气管的读数时,要使装置内外压强保持一致,具体操作为。