(14分)氨是重要的化工原料,可以制尿素等多种产品
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如下图所示。
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料氕中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l)
[Cu(NH3)3]CH3COO·CO(l) 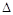 H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出(NH3)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
(5)已知某些弱电解质在水中的电离平衡常数(25 ℃)如下表:
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+ )>c(CO32-)>c(HCO3- )>c(NH3·H2O)
B.c(NH4+ )+c(H+)=c(HCO3- )>c(OH-)+ c(CO32-)
C.c(HCO3- )+c(H2CO3)+ c(CO32-)="0.1" mol·L-1
D.c(NH4+ )+c(NH3·H2O)=2c(CO32-)>2c(HCO3- )+ 2c(H2CO3)
在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=" 0.0080" mol·L-1
(1)该反应的平衡常数K= (填数值)。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20 mol,达到化学平衡状态时:
C(H2)= mol ·L-1;c(HI)= mol·L-1。
(8分)完成下列方程式的书写(若有几种有机产物只写主要产物):
(1)丙烯与HBr反应:_________________________________________。
(2)1,3—丁二烯常温下与Br2等物质的量反应:______________________________。
(3)2—溴丁烷发生消去反应:___________________________________。
(4)甲苯与Cl2光照条件下等物质的量反应:___________________________________。
有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。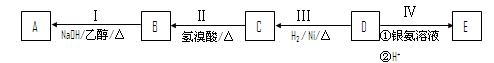
请回答:
(1)D的分子式为;
(2)B中所含官能团的名称为;
(3)Ⅲ的反应类型为(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)写出下列反应的化学方程式:
Ⅰ:;
Ⅱ:;
C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,它们的结构简式为和;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电 子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式 ,F位于周期表区。
(2)A、B、C的第一电离能由小到大的顺序为。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元素 |
M |
F |
|
| 电能 (kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知 ,气态M2+再失去一个电子比气态F2+再失去一个电子
,气态M2+再失去一个电子比气态F2+再失去一个电子
难。对此,你的解释是;
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为_______,一个晶胞中F原子的数目为______ 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
__________________________________。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO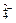 离子,加入下列沉淀剂的顺序是(填序号)。
离子,加入下列沉淀剂的顺序是(填序号)。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是。
(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所 得消毒液仅含一种溶质,写出相应的化学方程式:___________________________。
得消毒液仅含一种溶质,写出相应的化学方程式:___________________________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是。
(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。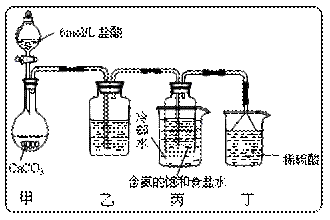
试回答下列有关问题:
①乙装置中的试剂是;
②丁装置中稀硫酸的作用是;
③实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
(6)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是。(已知碳酸的酸性强于次氯酸)。