常温下,将Na2CO3和NaHCO3混合物〔n(Na2CO3)/n(NaHCO3)="a" a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是
| A.a=1则c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B.a=2则c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.a为任意值时,则c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D.a=0则c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
下列实验现象所对应的离子方程式不正确的是()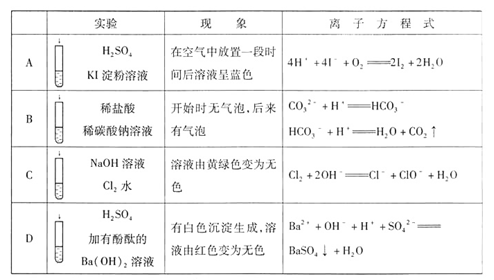
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是()
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.图中的b>a |
| C.阳极区pH增大 |
| D.该过程中的产品主要为H2SO4和H2 |
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3 mol Z。下列说法正确的是()
Z(g),经60s达到平衡,生成0.3 mol Z。下列说法正确的是()
| A.以X浓度变化表示的反应速率为0.001mol ·L-1·s-1 |
| B.将容器体积变为20L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
下列各项表述中与示意图一致的是()
| A.图①表示第三周期元素原子半径的变化规律 |
| B.图②a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g) △H>0,在使用和未使用催化剂时,反应过程中的能量变化 |
| C.图③所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是()
| A.W、X、Y形成的简单离子核外电子数相同 |
| B.Z和W可形成原子个数比为1:2和1:3的共价化合物 |
| C.Y和Z形成的化合物可以通过复分解反应制得 |
| D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应 |