甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第二周期IVA族元素,则丙一定是甲烷的同系物 |
| D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素 |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
| A.原子半径由小到大的顺序:X< Y < Z< W |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1 |
【原创】化学与生产、生活、环境密切相关,则下列叙述正确的是
| A.SO2是大气污染物,可造成酸雨和光化学烟雾 |
| B.沾附在油脂可用热的纯碱溶液洗涤,利用了盐的水解反应和酯的水解反应 |
C.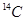 可用于文物年代的鉴定, 可用于文物年代的鉴定,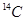 与 与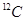 互为同素异形体 互为同素异形体 |
| D.河流入海口易形成的三角洲,与胶体的聚沉有关,向豆浆中加入石膏制豆腐,与胶体无关 |
下列浓度关系正确的是
| A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) |
| B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-) |
| C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+) |
| D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
【原创】下列说法或表达正确的是
| A.加入铝粉能放出气体的溶液可能含有:NH4+、K+、Cl‾、NO3‾ |
| B.含有1 mol·L-1 Fe3+的溶液可能含有:Na+、Ca2+、I-、Br‾ |
| C.FeS溶于过量稀硝酸的离子方程式为:FeS + 2H+=Fe2+ + H2↑ |
| D.向NaHCO3溶液中加入过量的石灰水产生白色沉淀:HCO3- + Ca2+ + OH- =CaCO3↓+ H2O |
【改编】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是
| A.它的分子式为C9H12 |
| B.柠檬烯能使溴水和酸性高锰酸钾溶液褪色,而且原理相同 |
| C.一定条件下,它可以发生加成、取代、氧化、还原、加聚等反应 |
D.它和丁基苯( )互为同分异构体 )互为同分异构体 |