下列实验设计及其对应的离子方程式均正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3 +3H+ =Fe3++3H2O |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO- |
D.向Ba(OH)2溶液中滴加H2SO4溶液:Ba2++2OH-+2H++ =BaSO4↓+2H2O =BaSO4↓+2H2O |
下列现象或事实可用同一原理解释的是
| A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| B.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化 |
| C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色 |
| D.漂白粉和水玻璃长期暴露在空气中变质 |
下列物质间的转化在给定条件下能一步实现的是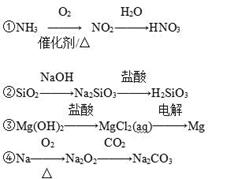
| A.①②③ | B.③④ | C.①④ | D.②④ |
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
| A.元素Y、P的简单氢化物中化学键类型相同 |
| B.原子半径:X>Y |
| C.最高价氧化物的水化物酸性:P<Q |
| D.X、Q两元素的最高正化合价相同 |
某同学对一瓶Na2SO3固体样品进行如下实验:取出少量,加水完全溶解,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,仍有白色沉淀剩余。下述叙述正确的是
| A.无法确定样品中钠、硫元素的质量比 |
| B.Na2SO3已被氧化 |
| C.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| D.加入稀硝酸后的沉淀一定是BaSO4 |
已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是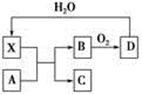
| A.X使蔗糖变黑的现象主要体现了X的脱水性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 |
| D.工业上,B转化为D的反应条件为高温、高压、使用催化剂 |