多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 • 2H2O,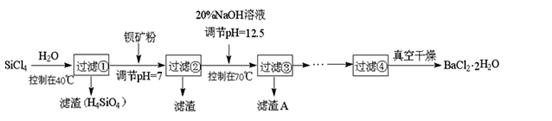
工艺流程如下:
已知:①常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
②BaCO3的相对分子质量是197; BaCl2 • 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4 蒸
汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2
②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经____________________、______________________、过滤、洗涤,再经真空干燥后得到BaCl2 • 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 • 2H2O___________吨。
利用“化学计量在实验中的应用”相关知识填空.
(1)含有6.02×1023个氢原子的H2SO4的物质的量是__________;
(2)在一定的温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积化合物,则该化合物的化学式是__________;
(3)三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl﹣、SO42﹣,则n(SO42﹣)为__________.
在下列物质中:①Na ②Fe(OH)2固体③Na2O固体 ④CO2 ⑤FeCl3溶液 ⑥蔗糖溶液 ⑦熔融MgSO4⑧NaCl晶体(请用序号填空).
属于碱性氧化物的是__________,属于盐的是__________,
属于电解质的是__________,能导电的是__________.
下图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式 。
②在X电极附近观察到的现象是 。
(2)若X、Y都是惰性电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后,X电极上有3.2g铜析出,写出电解过程中有关反应的离子方程式 ,此时直流电源已输出 mol电子。
(3)如果要用电解的方法精炼粗铜(含有Fe、Zn、Pt、C等杂质),电解质溶液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式 。
②精炼完成后,硫酸铜溶液的浓度 (填“变大”、“变小”或“不变”)
(4)铅蓄电池反应的化学方程式是Pb+PbO2+2H2SO4=2PbSO4+2H2O。若以铅蓄电池为电源,用惰性电极电解CuSO4溶液,在电解过程中生成11.2LO2(标准状况),则铅蓄电池中消耗的硫酸的物质的量为 。
A和B两种有机物可以互溶,有关性质如下:
| 相对密度(20℃) |
熔点 |
沸点 |
溶解性 |
|
| A |
0.7137 |
-116.6°C |
34.5°C |
不溶于水 |
| B |
0.7893 |
-117.3°C |
78.5°C |
与水以任意比混溶 |
(1)要除去A和B的混合物中的少量A,可采用_______________方法即可得到B。
A.蒸馏 B.重结晶C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种化学环境不同的氯原子,强度之比为3︰2︰1。则B的结构简式为__________。
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为_________________。
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g。计算混合物中A和B的物质的量之比______________。
某二元酸(化学式用H2B表示)在水中的电离方程式H2B=H++HB-;HB- H++B2-回答下列问题:
H++B2-回答下列问题:
(1)Na2B溶液显______(填“酸性”,“中性”,或“碱性”)。理由是___________(用离子方程式表示)。
(2)在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中氢离子的物质的量浓度可能是____0.11 mol/L(填“<”、“>”、“=”)理由是: 。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是_____________。