(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是 。(填写编号)
①粗盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)实验室欲配置450mL0.25mol·L-1NaOH溶液:
①配制时除需用胶头滴管、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是 。
②通过计算,应用托盘天平称取 NaOH固体,若将物码放反,则所配制溶液物质的量浓度 。(填“偏大”、“偏小”或“不变”)
③定容时,仰视液面,则所配溶液物质的量浓度 。(填“偏大”、“偏小”或“不变”)
某化学课外小组用下图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。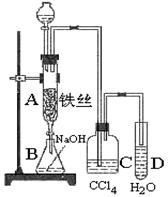
(1)写出A中反应的化学方程式
⑵实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关反应的化学方程式。
⑶ C中盛放CCl4的作用是。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明该反应为取代反应。另一种验证的方法是向试管D中加入,现象是。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。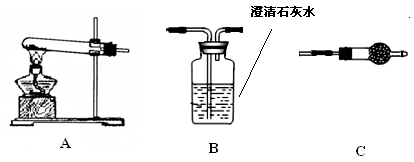

 (1)各装置连接顺序为。
(1)各装置连接顺序为。
(2)装置C中装有试剂的名称是。
(3)能证明生成物中有CuCO3的实验现象是。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置进行定量分析来测定其组成。
(1)装置C中碱石灰的作用是,实验开始时和实验结束时都要通入过量的空气其作用分别是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设假设1:红色粉末是Fe2O3假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?简述你的理由(不需写出反应的方程式 )
(3)若固体粉末完全溶解无固体存在 , 滴加KSCN 试剂时溶液不变红色 , 则证明原固体粉末是,写出发生反应的离子方程式、、。
探究延伸经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为。
下图所示为苯和溴的取代反应的实验改进后的装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
⑴向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就会发生反应。该反应中铁屑粉的作用是___________________________,写出A中发生反应的化学方程式(有机物写结构简式)________________________________________。
⑵试管C中苯的作用是。反应开始后,观察D和E两支试管,看到的现象为___________________________________________。
⑶F中发生反应的离子方程式是___________________。
⑷在上述整套装置中,采取了防倒吸措施的装置是________________(填字母代号)。
⑸实验室得到粗溴苯后,要用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10% NaOH溶液洗 ⑤水洗正确的操作顺序是(填写序号)
| A.①②③④⑤ | B.②④⑤③① |
| C.④②③①⑤ | D.②④①⑤③ |
某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为;
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是
①,②(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下) Cl2完全反应,则反应过程中转移电子的物质的量为。