NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如下:
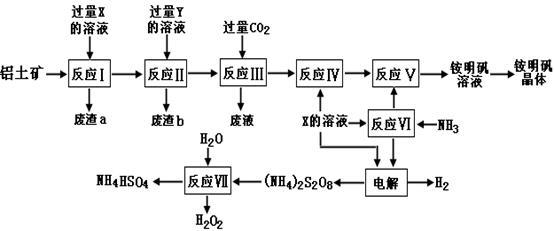
(1)废渣a、b 的成分分别是_______________、_______________。(写化学式)
(2)流程图中X的化学式为_______________。
(3)反应Ⅲ的离子方程式为________________,从铵明矾溶液中获得铵明矾晶体的操作依次为__________(填操作名称)、冷却结晶、过滤洗涤。
(4)反应Ⅶ的化学方程式为___________________。
(5)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的离子反应是 _______。(填选项字母)
| A.NH4+ + SO42— + Ba2+ + OH—= BaSO4↓ + NH3·H2O |
| B.2Al3+ + 3SO42— + 3Ba2+ + 6OH—= 3BaSO4↓ + 2Al(OH)3↓ |
| C.Al3+ + 2SO42— + 2Ba2+ + 4OH—= 2BaSO4↓ + AlO2— + 2H2O |
| D.NH4+ + Al3+ + 2SO42— + 2Ba2+ + 4OH—= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。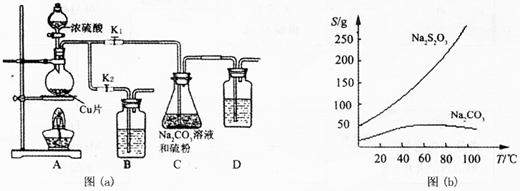
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是.
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的(填编号)。
A.NaOH溶液B.浓H2SO4
C.酸性KMnO4溶液D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH时,打开K2、关闭K1并停止加热;C中溶液要控制pH的原因是。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液、过滤、、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式,
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO24全部转化为Cr2O2-7;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:
Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O
I2+2S2O32-=S4O62-+2I-
则该废水中Ba2+的物质的量浓度为。
(本题共12分)阿司匹林( )是世界上应用最广泛的解热、镇痛药。因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药。因乙酸很难与酚羟基酯化,工业上以水杨酸(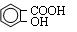 )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林。粗产品中主要的副产物是水杨酸多聚物,需进一步提纯。反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林。粗产品中主要的副产物是水杨酸多聚物,需进一步提纯。反应原理和相关物理数据如下:
| 名称 |
常温下状态 |
水中溶解性 |
| 乙酸酐 |
液 |
与水反应 |
| 阿司匹林 |
固 |
冷水中微溶;热水中易溶 |
| 水杨酸多聚物 |
固 |
难溶 |
下图是工业上制备并提纯阿司匹林的部分流程: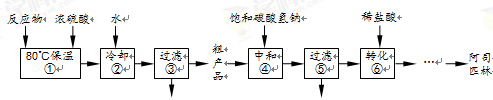
完成下列填空:
37.步骤①的反应装置如图所示(加热装置未画出),实验仪器必须干燥的原因是_____________;冷凝管的作用是___________;对烧瓶进行加热的合适方法是____________。
38.反应中加入的乙酸酐是过量的,过量的目的是_____________;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是______;检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是______(写化学式)。
39.步骤④中加入NaHCO3的目的是_________________。
40.步骤⑤过滤得到的滤渣主要是_____________。步骤⑥中加入盐酸后发生反应的化学方程式为______。
41.从步骤⑥到成品纯阿司匹林的剩余操作依次有_____________________。
(本题共12分)氯化钠是氯碱工业的主要原料,其晶体不带有结晶水,饱和食盐水也是实验室常用试剂。完成下列填空:
32.粗盐中含有Ca2+、Mg2+、SO42―等离子和少量泥沙,某同学设计的提纯步骤依次为:溶解、过滤、加入沉淀剂、调pH、蒸发结晶。其中还缺少的步骤是_________。
33.电解饱和食盐水实验中,检验阳极产物的试剂是________________;若用粗盐配制饱和食盐水进行电解,则阴极区可能出现的异常现象是_________________。
34.氯碱厂称固体烧碱为“片碱”。用滴定法测定片碱中杂质Na2CO3含量的过程如下:
称取样品,加水溶解;加入酚酞试液,用标准盐酸滴定至溶液由红色刚好变为无色;再加甲基橙,继续用标准盐酸滴定至终点。数据处理。实验中用于溶解片碱的蒸馏水必须事先煮沸一段时间,煮沸的目的是_______;用甲基橙作指示剂时,判断滴定达到终点的现象是________________;用酚酞作指示剂时,发生反应的离子方程式为_________________。
35.下列关于饱和食盐水的用途及装置设计正确的是_________(填写编号)。
a.模拟工业制纯碱b.制乙酸乙酯实验中接受产物
c.除去氯气中的氯化氢d.实验室制乙炔
36.在饱和食盐水中加入浓硫酸,会有大量固体析出。过滤、洗涤、得干燥固体。为确定该固体的成份,进行以下实验:①取少量固体溶于水,测得溶液显中性;
②称取1.961 g固体于坩埚中加热,发现有水生成,继续加热至固体恒重,称量质量为1.331 g。判断固体已恒重的操作是____________________;
③将1.331 g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀1.165 g。则原固体的成份是______________(写化学式)。
(本题共12分)在饱和碳酸钠溶液中通入CO2,将所得溶液小心蒸干,得到固体A,为分析A的成分,设计如下实验方案。
32.甲实验:用pH计检验A是否为纯净的碳酸氢钠。25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是__________________。
33.乙实验:将A配成溶液与BaCl2溶液等体积混合,通过观察实验现象判断A是否为纯净的碳酸氢钠,下表是几组实验的现象: 
产生浑浊的原因可能是①A中含有碳酸钠; ②________________________________________。
34.丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000 mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是________________________。
35.丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于________(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行______次,当剩余固体质量为____克(保留3位小数)时,证明A为纯净的碳酸氢钠固体。
(本题共12分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3 · 5H2O)。
Ⅰ.【查阅资料】
①Na2S2O3 · 5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
③Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【实验装置】
如图所示(省略夹持装置):
Ⅲ.【实验步骤】
①如图示加入试剂。
②先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。C中发生反应:Na2CO3 + 2Na2S + 4SO2 →3Na2S2O3 + CO2
③待Na2S和Na2CO3完全消耗后,结束反应。C中溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥得到Na2S2O3 · 5H2O的粗产品。
35、加入试剂之前须进行的操作是;b瓶的名称是,作用是。
36、A中不可用稀硫酸的原因为:。
37、E中的试剂可以选用(选填序号)。
a.稀H2SO4b.NaOH溶液 c.饱和NaHSO3溶液 d.Na2CO3溶液
38、为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案:
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,取沉淀,加入足量稀盐酸,(填实验现象),则可确定产品中含有Na2SO3和Na2SO4。
39、为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤②进行了改进,改进后的操作是。
40、所制得的粗产品可以通过方法进一步提纯得到纯Na2S2O3 · 5H2O。