(本题共12分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3 · 5H2O)。
Ⅰ.【查阅资料】
①Na2S2O3 · 5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
③Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【实验装置】
如图所示(省略夹持装置):
Ⅲ.【实验步骤】
①如图示加入试剂。
②先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。C中发生反应:Na2CO3 + 2Na2S + 4SO2 →3Na2S2O3 + CO2
③待Na2S和Na2CO3完全消耗后,结束反应。C中溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥得到Na2S2O3 · 5H2O的粗产品。
35、加入试剂之前须进行的操作是 ;b瓶的名称是 ,作用是 。
36、A中不可用稀硫酸的原因为: 。
37、E中的试剂可以选用 (选填序号)。
a.稀H2SO4 b.NaOH溶液 c.饱和NaHSO3溶液 d.Na2CO3溶液
38、为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案:
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,取沉淀,加入足量稀盐酸, (填实验现象),则可确定产品中含有Na2SO3和Na2SO4。
39、为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤②进行了改进,改进后的操作是 。
40、所制得的粗产品可以通过 方法进一步提纯得到纯Na2S2O3 · 5H2O。
(15分)一种广泛用作药剂、有机氯化剂,及用于制造染料、橡胶的化工原料——硫酰氯(SO2Cl2),常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3kJ·mol-1
(1)仪器A的名称是 ;甲中活性炭的作用是__ ____。
(2)干燥管B中盛放的药品是 。
(3)实验时从仪器C中放出液体的操作方法是 。
(4)装置乙中盛放的物质为 ,若缺少装置乙,对实验结果有什么影响? 。
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯,同时还有另外一种物质生成,该反应的化学方程式为 ,分离的产物的方法是 。
A.重结晶B.过滤 C.蒸馏D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (填序号)。
A.控制气流速度,宜慢不宜快
B.水浴加热三颈烧瓶
C.若三颈烧瓶发烫,可适当降温
(18分)(1)硫酸是一种重要的含氧酸。实验室用浓硫酸与乙二酸(H2C2O4)晶体共热,可获得CO与CO2的混合气体,再将混合气进一步通过 (填一种试剂的名称)即可得纯净干燥的CO。在此反应中,硫酸体现了 性质。
(2)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净[Cl2Na(NCO)3]先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为 。
②亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
③亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体。请写出无水亚硫酸钠受热分解的反应方程式 。
(3)某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验: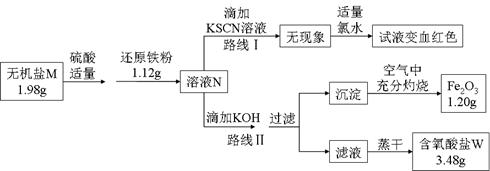
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②上图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应得混合溶液N;
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验;
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W。
请按要求回答下列问题:
①由路线Ⅰ的现象可知,溶液N中含有的阳离子是 。
②由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g。
③无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 。
(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下: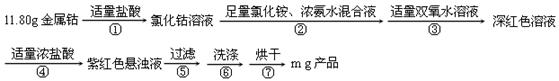

相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑;[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g) + CO2(g)  NH2COONH4(s)ΔH<0
NH2COONH4(s)ΔH<0
(1)如用图1装置制取氨气,你所选择的试剂是 。制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是 。
(3)液体石蜡鼓泡瓶的作用是 。
(4)从反应后的混合物中分离出产品的实验方法是 (填写操作名称);为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40℃以下烘干
(5)尾气处理装置如图2所示。双通玻璃管的作用 ;浓硫酸的作用 。
(6)称取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为 。(精确到2位小数)
(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。