(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:

①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO(图中夹持装置已略去)。 (1)装置C的作用是 _______,装置E的作用是。
(1)装置C的作用是 _______,装置E的作用是。
(2)乙二酸受热分解的反应方程式是。
(3)①证明分解产物中有CO2的现象是 _______________________。
②证明分解产物中有CO的现象是__ ______。
(4)该装置有一个不足之处,请写出弥补这个不足之处的理由和具体方法:_____________ __________ __________。
某课外活动小组同学用如图Ⅰ装置进行实验,试回答下列问题。
图I图II
(1)若开始时开关K与a连接,则B极的电极反应式为_____________。
(2)若开始时开关K与b连接,则总反应的离子方程式为_____________;
有关上述实验,下列说法正确的是(填序号)_____________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模仿工业上用离子交换膜法制烧碱的方法,设想用如图Ⅱ装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽工作时,通过阴离子交换膜的离子数_______(填“大于” “小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_____ ________。
(4)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为kg。
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
Ⅰ预处理:将(1)中获得的混合物放在如右图装置中处理足够时间。
Ⅱ检验过程
| 操作 |
现象及结论 |
| 基于方案一: |
|
| 基于方案二: |
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、(写其中2个)
(2)将有机层和水层分离的操作方法叫,实验式完成此操作所用到的一种主要仪器是。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是。
(4)写出电解过程中(两电极都是惰性电极)阴极发生反应的电极反应式
(5)“循环Ⅲ”中反萃取剂的主要成分是
张明同学设计下图所示装置,用粗铁粒与1890g·L-1(质量分数10%)的硝酸反应制取NO气体。请回答有关问题。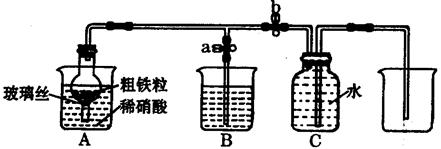
①1890g·L-1硝酸的物质的量浓度为。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是。
③当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是。B装置烧杯中液体的作用是。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响?。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是(用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 |
操作 |
现象与结论 |
| 第一步 |
取少量液体装于试管,向试管中滴入几滴KSCN溶液 |
|
| 第二步 |
若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |