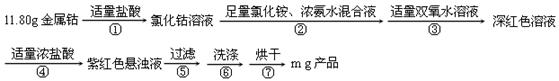
(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下:

相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑ ;[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
(15分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。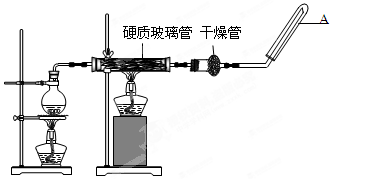
(1)写出该反应的反应方程式 ;
; 并指明该氧化还原反应的还原剂是,氧化剂是。
并指明该氧化还原反应的还原剂是,氧化剂是。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3=" 2NaI" + Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用____________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液40.00 mL,则废水中Cl2的物质的量浓度为__________________________。
(4)以上实验步骤中有一处明显的操作错误,请指出.
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0mL于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2—3滴
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01mol/L的Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6
请回答下列问题:
(1)步骤①加入的指示剂是
(2)步骤②应使用式滴定管
(3)步骤③当待测液由色变为色且半分钟不变化即达终点,若耗去Na2S2O3溶液20.0mL,则废水中Cl2的物质的量浓度为
(4)从实验操作步骤上看,氯气的实际浓度比所测浓度(填“偏大”、“偏小”或“相等”)
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去)。图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15 m L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
(1)③试管中制取次氯酸钠的化学方程式为
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格。
| 实验现象 |
原因 |
| 溶液最初从紫色变为 色 |
氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 |
|
| 最后溶液从无色逐渐变为色 |
(3)此实验有一个明显的不足之处,应如何改进? 
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该 实验中反应速率明显加快的原因可能是_____________________。
实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 |
B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol ·L-1的 ·L-1的硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
||
| ② |
0.5 |
||||
| ③ |