(本题共12分)氯化钠是氯碱工业的主要原料,其晶体不带有结晶水,饱和食盐水也是实验室常用试剂。完成下列填空:
32.粗盐中含有Ca2+、Mg2+、SO42―等离子和少量泥沙,某同学设计的提纯步骤依次为:溶解、过滤、加入沉淀剂、调pH、蒸发结晶。其中还缺少的步骤是_________。
33.电解饱和食盐水实验中,检验阳极产物的试剂是________________;若用粗盐配制饱和食盐水进行电解,则阴极区可能出现的异常现象是_________________。
34.氯碱厂称固体烧碱为“片碱”。用滴定法测定片碱中杂质Na2CO3含量的过程如下:
称取样品,加水溶解;加入酚酞试液,用标准盐酸滴定至溶液由红色刚好变为无色;再加甲基橙,继续用标准盐酸滴定至终点。数据处理。实验中用于溶解片碱的蒸馏水必须事先煮沸一段时间,煮沸的目的是_______;用甲基橙作指示剂时,判断滴定达到终点的现象是________________;用酚酞作指示剂时,发生反应的离子方程式为_________________。
35.下列关于饱和食盐水的用途及装置设计正确的是_________(填写编号)。
a.模拟工业制纯碱 b.制乙酸乙酯实验中接受产物
c.除去氯气中的氯化氢 d.实验室制乙炔
36.在饱和食盐水中加入浓硫酸,会有大量固体析出。过滤、洗涤、得干燥固体。为确定该固体的成份,进行以下实验:①取少量固体溶于水,测得溶液显中性;
②称取1.961 g固体于坩埚中加热,发现有水生成,继续加热至固体恒重,称量质量为1.331 g。判断固体已恒重的操作是____________________;
③将1.331 g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀1.165 g。则原固体的成份是______________(写化学式)。
【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。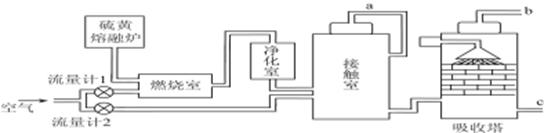
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是____________________________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式__________________________________________、______________________________、___________________________________________。
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为。
(3)精制过程要除去SO42-,可选择下列溶液中的(填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、、(填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是;标准碘溶液应盛放在(填“碱式”或“酸式”)滴定管中。
(2)装置a的作用是
(填序号)。
| A.除去空气中的二氧化碳 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察、控制空气流速 |
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”),写出影响测定结果的化学方程式:。
(4)上述反应结束后,仍需通一段时间的空气,其目的是。
(5)通过计算可知,该黄铜矿的纯度为。
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
(1)混合①使用冰水的目的是;
(2)操作II和III的名称是,;
(3)混合②中发生反应的离子方程式为;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂(填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ()
| A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816 AgBr(s)+Cl-(aq)平衡常数Κ≈816 |
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr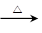 CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| 乙醇 |
溴乙烷 |
|
| 状态 |
无色液体 |
无色液体 |
| 密度/g · cm-3 |
0.8 |
1.4 |
| 沸点/℃ |
78.5 |
119.0 |
| 熔点/℃ |
-l30 |
38.4 |

(1)圆底烧瓶中加入的反应物是溴化钠、和2:1的硫酸。配制体积比2:1的硫酸所用的仪器为 (选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第
层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加
入 (选填编号)然后再进行一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为。