( 17分)欲配制1 mol/L的氢氧化钠溶液250mL,
(1)实验室所需的仪器有: , , , , 。
(2)完成下列步骤:
①称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中,加少量蒸馏水将其溶解,待冷却后将溶液沿 移入 中。
③用少量蒸馏水洗涤 次,将洗涤液转移入 中,在操作过程中不损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④加水定容过程中离刻度线 时,改用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入试剂瓶中并贴好标签。
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.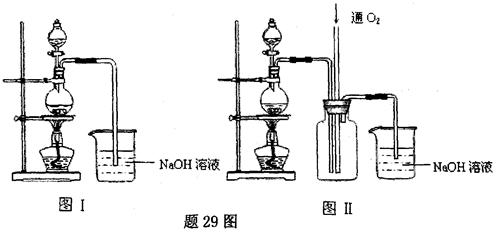
(1)怎样检查图I装置的气密性。
(2)图I中分液漏斗内装的液体是。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是,
,,(可不答满).
(4)课外兴趣小组同学在测定胆矾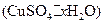 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 |
加热后质量 |
|
| m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
| 5.4g |
7.9g |
6.8g |
①为完成测定,题29图Ⅲ中还缺少的仪器名称是。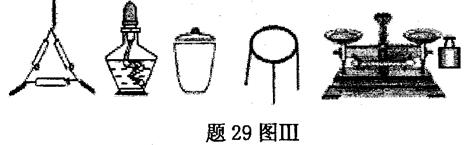
②判断样品已恒重的方法是。
③测定所得胆矾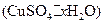 中结晶水含量的实验中,称量操作至少进行次。
中结晶水含量的实验中,称量操作至少进行次。
④课外兴趣小组的测定结果x值(与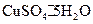 相比
相比 )(填“偏高”、“偏低”、“不变”),可能的原因是。(填字母序号)
)(填“偏高”、“偏低”、“不变”),可能的原因是。(填字母序号)
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
Ⅰ.为制取较纯净的溴苯和验证反应机理,某化学课外小组设计了实验装置(如右图)。
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式
(2)实验结束时,打开A下端的活塞,让反应 液流入B中,充分振荡,目的是
液流入B中,充分振荡,目的是 。
。
(3)C中盛放CCl4的作用是。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。设计另外一种方案证明之(写出操作、现象及结论)
Ⅱ.含苯酚的工业废水处理的参考方案如下:
回答下列问题:
(1)设备①进行的是操作____________(填写操作名称),实验室这一步操作所用的仪器是:____________;
(2)由设备②进入设备③的物质A是,由设备③进入设备④的物质B是;
(3)在设备③中发生反应的化学方程式为_____________________;
(4)在设备④中, 物质B的水溶液和CaO反应,产物是、和水,可通过________操作(填写操作名称)分离产物;
(5)上图中,能循环使用的物质是C6H6、CaO、______、______。
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所推出的结论是:第一:有氧气生成;第二:。
Na2O2跟水反应的化学方程式是。
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行实验,以证明上述结论。
①用以验证第一条结论的实验操作及现象是:
②用以验证第二条结论的实验操作及现象是:
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请从另外一个角度(即不能再使用酸碱指示剂)设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。
。
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):


查阅资料可知,HSO-3的酸性强弱与H2CO3相近。请回答下列问题:
(1)上述装置的接口连接顺序依次是(填导管接口字母)。
(2)装置A、D中发生反应的化学方程式是:A, D。
(3)证明SO2具有氧化性的现象是;证明SO2具有还原性的实验中,反应的离子方程式是。
(4)C试管中NaOH溶液的作用是,CCl4的作用是。
(5)实验过程中还观察到A试管内产生黑色沉淀,查资料可知,该黑色沉淀是副反应产生的CuS和Cu2S。收集黑色沉淀经过滤、洗净、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现黑色固体质量减少a%,则a值范围是。
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)
Ⅱ.某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。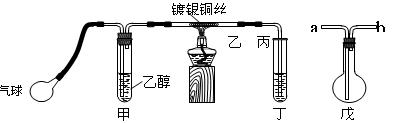
填写下列空白:
(1)甲装置常常浸在70~80℃
的水浴中,目的是。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接、__接丙。