(本题8分)汽车尾气是造成雾霾天气的重要原因之一。已知:
①N2(g)+O2(g) 2NO(g) ΔH1 ②2NO(g)+O2(g)
2NO(g) ΔH1 ②2NO(g)+O2(g) 2NO2(g) ΔH2
2NO2(g) ΔH2
③CO2(g) CO(g)+1/2O2(g) ΔH3 ④2CO(g)+2NO(g)
CO(g)+1/2O2(g) ΔH3 ④2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH4
N2(g)+2CO2(g) ΔH4
请完成以下问题:
(1)请根据反应①②③,确定反应④中ΔH4= 。
(2)根据图1,反应④的热化学方程式为: 。
该反应在 (填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(3)图2表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为: , X、Y、Z三点,CO的转化率由大到小的顺序是 。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K= (算出数值)。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01 mol/L、a mol/L、0.01 mol/L、0.04 mol/L,要使反应向正方向进行,a的取值范围为 。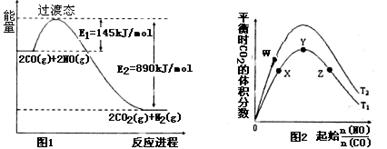
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线。
某元素M所形成的气态单质为双原子分子,共有三种形式,其式量分别为70、72、74,它们的物质的量之比为9∶6∶1,则:
(1) M有______种同位素,其质量数分别为_________________;
(2)各种同位素所占的原子百分比分别为多少?
(3)M2的平均式量为多少?
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。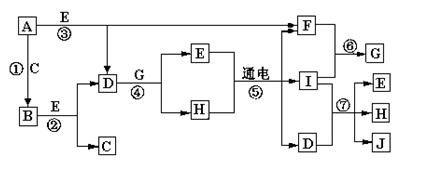
回答下列问题:
(1)B的化学式:,E的电子式_________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴、阳”)极附近溶液由无色变为红色,其原因是_________________ 。
如图所示: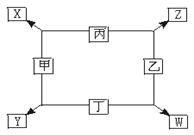
已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y, 在产物中元素甲呈负价。
在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是,乙是。
(2)甲与丙反应生成X的化学方程式是。
(3)乙与丁反应生成W的化学方程式是。
(1)1mol丙酮(CH3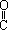 COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是。
COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是。
(3)B的甲酯可以聚合,聚合物的结构简式是。
X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是;Y和X的组成元素相同,Y的化学式是;1mol Z在加热时跟水反应的产物 需要用6mol的氢氧化钠才能完全中和,Z的化学式是,其中和产物的化学式是。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是。
需要用6mol的氢氧化钠才能完全中和,Z的化学式是,其中和产物的化学式是。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是。