在如图所示的三个容积相同的三个容器①、②、③进行如下的反应:3A(g)+B(g) 2C(g)△H<0
2C(g)△H<0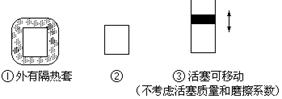
(1)若起始温度相同,分别向三个容器中充入3mol A和 1mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 (填容器编号)
(2)若维持温度不变,起始时②中投入3mol A、1mol B; ③中投入3mol A、1mol B和2mol C,则达到平衡时,两容器中B的转化率② ③(填<、>或=)
(3)若维持②③容器内温度和压强相等,起始时在②中投入3molA和1molB,在③中投入amol A和bmol B及cmol C,欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料量必须满足(用含a、b、c的关系式表达):
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式___________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
(1)下列装置可用于吸收气体X的是 (填代号)。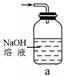



(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为 。
②实验时,依次进行如下操作:组装仪器、 、加装药品、通入气体、 、点燃酒精灯。
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为 。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定剂 EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2-+ 2H+。则CuSO4·5H2O质量分数为________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。
(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
(原创)用以下几种常见有机物填写下列空白:
a.CH4
b.C2H4
c.C6H6
d.C2H5OH
e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是 (用序号表示)。
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为 。
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为 L。
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
104.7 g |
| (澄清石灰水+广口瓶)的质量 |
312.0 g |
318.6 g |
根据实验数据填空:
①假设广口瓶里生成一种正盐,其质量为 g。
②混合气体中C、H两元素的物质的量之比为 。
③若混合气体是由CH4和C2H4组成,则二者的体积比为 。
(原创)铜及其化合物在工农业生产中都有着广泛应用。
(1)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2、Cu2S+O2=2Cu+SO2。当有1molCu生成,则第一个反应中转移电子 mol。
(2)某种处理火法炼铜中SO2废气的工艺流程如下图所示。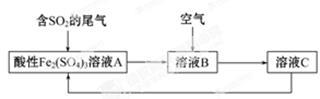
①溶液A中发生的反应为 。
②由流程图可推知Fe3+、O2、SO42-的氧化性由强到弱的顺序为 。
(3)已知反应:3Cu+2NO3-+xH+=3Cu2++2R+yH2O。则
①反应中的x= 。
②反应产物R的化学式为 。
③参加反应的Cu和消耗的HNO3物质的量之比为 。