室温下,某溶液中由水电离出的c(OH-)=10-5 mol·L-1,则其溶质可能是
| A.CH3COOH | B.H2SO4 | C.NaOH | D.Na2CO3 |
苯酚和苯甲醇共同的化学性质是( )
| A.酸性 | B.与钠反应放出氢气 |
| C.遇FeCl3溶液显紫色 | D.与NaOH溶液反应 |
香兰素是重要的香料之一,它可由丁香酚经多步反应合成.
有关上述两种化合物的说法正确的是( )
| A.常温下,1 mol丁香酚只能与1 mol Br2反应 |
| B.丁香酚不能与FeCl3溶液发生显色反应 |
| C.1 mol香兰素最多能与4 mol氢气发生加成反应 |
| D.香兰素分子中至少有11个原子共平面 |
下列物质既能发生消去反应生成相应的烯烃,又能被氧化生成相应醛的是( )
A.CH3OH B.CH3CH2CH2OH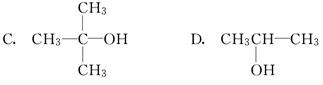
丙烯醇(CH2===CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
| A.①②③ | B.①②③④ |
| C.①②③④⑤ | D.①③④ |
居室空气污染的主要来源之一是人们使用的装修材料,它们会释放出一种有刺激性气味的气体,该气体是( )
| A.甲烷 | B.氨气 | C.甲醛 | D.二氧化硫 |