下列依据热化学方程式得出的结论正确的是
| A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ |
| B.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1 |
| C.已知2C(s)+2O2(g)=2CO2(g) △H=a, 2C(s)+O2(g)=2CO(g) △H=b,则a>b |
| D.已知P (白磷,s)=P (红磷,s) △H<0,则白磷比红磷稳定 |
为了减少大气污染,许多城市推广使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是()
| A.甲烷 | B.碳氢化合物 | C.氢气 | D.汽油 |
下列说法中正确的是()
| A.式量相同的物质是同种物质 | B.分子式相同的不同有机物一定是同分异构体 |
| C.具有同一通式的物质属于同系物 | D.分子中含有碳与氢的化合物是烃类 |
丁烷(C4H10)失去1个H原子后得到丁基(—C4H9),丁基(—C4H9)共有()
| A.2种 | B.3种 | C.4种 | D.5种 |
将a(O2)、b(CH4)、c(Na2O2)放入密闭容器中,在150℃条件下电火花引发反应,反应后容器中的压强为零,由此作出的正确结论是()
| A.原a、b、c物质的量之比为1∶2∶6,反应后容器中生成Na2CO3和NaHCO3的混合物 |
| B.原a、b、c物质的量之比为2∶1∶4,反应后容器中生成Na2CO3和NaOH的混合物 |
| C.原a、b、c物质的量之比为1∶2∶6,反应后容器中生成Na2CO3和NaOH的混合物 |
| D.原a、b、c物质的量之比为2∶1∶4,反应后容器中生成NaHCO3和NaOH的混合物 |
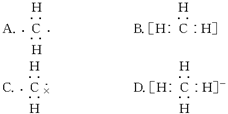
下列表示甲基的电子式中,正确的是()