下列说法中不正确的是
①质子数相同的微粒一定属于同一种元素
②共价化合物中不存在离子键
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④电子数相同的微粒不一定是同一种元素
⑤非金属元素之间不可能形成离子键
⑥离子键是指阴阳离子间的静电吸引力
⑦水受热不容易分解,原因是水分子间存在氢键
| A.②③⑤⑥ | B.①③⑤⑦ | C.①⑤⑥⑦ | D.③④⑤⑥ |
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.v(A) = 0.7mol·L-1·min-1B.v(B) = 0.3mol·L-1·min-1
C.v(C) = 0.9mol·L-1·min-1 D.v(D) = 1.1mol·L-1·min-1
根据热化学方程式(在101 kPa时):S(s)+O2(g)=SO2(g) ΔH=-297.2kJ/mol
分析下列说法中不正确的是
| A.S的燃烧热为 297.2 kJ/mol |
| B.S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ |
| C.S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ |
| D.形成1 mol SO 2 中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
关于中和热测定实验的下列说法不正确的是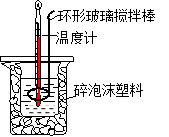
| A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B.使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C.向盛装酸的烧杯中加碱时要小心缓慢的分几次加入 |
| D.测了酸后的温度计要用水清洗后再测碱的温度 |
25℃时,水的电离达到平衡:H2O H++OH-;DH>0,则下列叙述正确的是
H++OH-;DH>0,则下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
下列说法不正确的是
| A.原电池外电路中电子由负极流向正极 |
| B.原电池中发生还原反应的电极是正极 |
| C.电解池中发生还原反应的电极是阳极 |
| D.电解池中质量增加的电极是阴极 |