氮及其化合物与人类各方面有着密切的联系。
Ⅰ.将一支充满标准状况下的NO2的试管倒置于水槽中,则试管中溶液的物质的量浓度为 (假设试管中的溶液不扩散);若试管中混有N2O4气体,则试管中溶液的物质的量浓度将 。(填偏大、偏小或不变)
Ⅱ.目前,消除氮氧化物污染有多种方法。
(1)用NH3转化法,在催化剂条件下可将NO、NO2转化成无毒的气体。写出NH3 与NO2反应的化学方程式并标出电子转移方向和数目 。
(2)用VLNaOH溶液完全可以吸收含aL NO、bL NO2、cL N2O4的混合气体(标准状况下),则NaOH溶液的物质的量浓度至少为 。
已知:2NO2+2NaOH=NaNO2+ NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2 (s) + 4HF(g)  SiF4 (g) + 2H2O(g)△H=-148.9 kJ/mol,根据题意完成下列填空:
SiF4 (g) + 2H2O(g)△H=-148.9 kJ/mol,根据题意完成下列填空:
(1)在地壳深处容易有__________气体逸出,在地壳浅处容易有________沉积
(2)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,____________(选填编号)。
a.2v正(HF)=v逆(H2O) b.混合气体的密度保持不变
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(3)如果上述反应的平衡常数K值变大,该反应_________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为__________________________。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________________________。
有两只密闭容器A和B,A容器有一个可移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时间这两只容器中分别充入等量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图。在保持400℃的条件下使之发生如下反应:2SO2+O2 2SO3。请填写下列空白:
2SO3。请填写下列空白: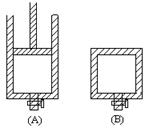
(1)达到平衡时所需的时间A容器比B容器(多、少),A容器中SO2的转化率比B容器中(大、小)。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量的He,
A容器中化学平衡_____________移动(向左、向右、不移动)。
B容器中化学平衡移动(向左、向右、不移动)。
(3)达到(1)所述平衡后,若向两容器中再通入等量的原反应气体,达到平衡时,A容器中SO3的百分含量。B容器中SO3的百分含量。(增大、减小、不变。)
用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=____________________(填表达式,不用化简)若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”)若将稀硫酸换成浓硫酸来做该实验,测得的△H___________(填“偏大”、“偏小”或“相同”)
(选做题)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-)D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:
。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=  =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=。