I.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空,
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)并说明理由 。
(2)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI十HNO3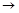 Se+I2+KNO3十H2O
Se+I2+KNO3十H2O
②I2+2Na2S2O3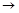 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.160 0 g,消耗了0.200 0 mol L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 。
L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 。
II .高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,具有良好的应用前景。其生产工艺如下:
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在 (填“温度较高’’或“温度较低”)的情况下进行。
(2)写出Fe(NO3)3在强碱性条件下与KClO反应制K2FeO4的离子方程式 。
(3)在“反应液I”中加KOH固体的目的是 (填序号)。
| A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3化为KClO |
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C1O2和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C1O2的消毒效率是C12的倍。
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理:。
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示: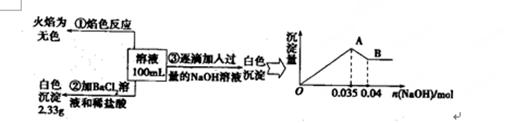
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为。
③试确定NO3-是否存在?(填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)(若不存在,此问不必作答)。
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2S04→Na2S04+Bi2(SO4)3+ NaMnO4+H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是。
③用单线桥表示该氧化还原反应。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式:。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是(填字号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。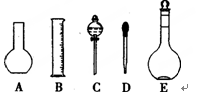
(2)下列操作中,是容量瓶所具备的功能有。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度(填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作:。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是。
(5)下列操作会使配制的NaOH溶液浓度偏低的是。
A.用滤纸称量NaOHB.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是。
(2)NO2和N2O4的混合气体中,NO2的体积分数是。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是mL。
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。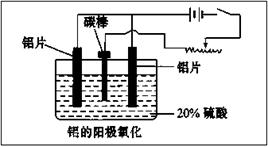
(3)下列说法正确的是。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色