如图所示: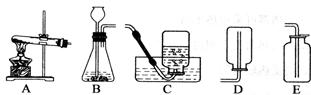
(1)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号),发生反应的化学方程式为 。其中 从长颈漏斗加入。
(2)用高锰酸钾制取氧气时,可选用的发生装置是 (填序号),发生反应的化学方程式为 ,如用C装置收集气体,应要等到__开始收集;收集氧气完毕,停止实验时,应先__,后__,目的是防止___。
(3)用E装置收集氧气的依据是 ,检验氧气是否集满的方法是 。
(4)要想收集更纯净的气体,最好用_________法收集。
如图是
两种固体物质的溶解度曲线,试回答:
(1)
时,两种固体物质的溶解度大小关系为
(填">""<""=");
(2)当
中含有少量
时,可以用法提纯
;
(3)在
时
的溶解度相等,此温度下所得溶液中溶质的质量分数最大为.
化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是(填字母序号).
| A. |
塑料保鲜薄 |
B. |
橡胶手套 |
C. |
棉布围裙 |
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有的功能.
(3)微量元素对人体健康的影响很大,如缺会引起贫血.
(4)多吃水果、蔬菜可补充人体需要的少量,此类物质可调节体内各种化学反应.
(5)媒体曾报道过面条可燃,有市民误以为是面条中加入了不安全的添加剂所致,但从化学的角度分析.面粉中含有的主要营养素淀粉就是可燃物.当
它时就能够燃烧,而且面粉在一定条件下还会发生爆炸,2010年2月某大型面粉厂灌装车间发生面粉爆炸,造成重大人员伤亡和经济损失.为避免类似事件的发生,生产过程中应采取的措施为.
| A. |
密封门窗,隔绝氧气 |
B. |
严禁吸烟,杜绝火源 |
C. |
轻拿轻放,减少粉尘扬起 |
D. |
提高淀粉的着火点 |
元素周期表是学习和研究化学的重要工具,试根据图示回答相应问题:

(1)图甲是铯元素在元素周期表中的信息,则铯元素属于(填"金属"或"非金属"),该元素原子的核外电子数为.
(2)图乙为元素周期表的一部分,
、
、
代表三种不同元素,以下 判断正确.
| A. |
原子序数 |
B. |
核外电子数: |
C. |
和 处于同一周期 |
观察一下我们的周围,就会发现金属的用途之广.
(1)根据如图的应用实例,可知金属具有的物理性质有.
(2)在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类;工业上用赤铁矿作原料炼铁的化学方程式为.
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为.

在宏观、微观和符号之间建立联系是化学学科的特点.
(1)在水、铜和氯化钠三种物质中,由分子构成的是.
(2)2012年3.15晚会播报了某地违规将有腐蚀性的二甲醚掺入液化石油气的内幕.二甲醚的化学式为
,它是由种元素组成,其中碳、氢、氧元素的质量比为.
(3)A、B、C、D表示4种物质,部分物质分子的微观示意图如下图所示.
A和B在一定条件下可发生如下反应A+2B═C+2D.则A、B、C、D中属于单质的是(填字母序号),A的化学式为.