B.[实验化学]
某化学小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素。
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表: 
| |
Ca(OH)2 |
Al(OH)3 |
Fe(OH)3 |
| pH |
≥13 |
≥5.2 |
≥4.1 |
(1)步骤①中加入盐酸的作用是
(2)步骤②中调节pH至6~7的目的是
(3)沉淀X所含主要物质的化学式为
(4)写出步骤③中发生反应的离子方程式
(5)试剂A为 ;试剂B为铝试剂,加入该试剂后的实验现象是
Ⅰ、分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图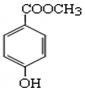
①下列对尼泊金酯的判断正确的是 。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.能与浓溴水反应产生白色沉淀。
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 。
(2)C8H8O3的另一种同分异构体甲如图: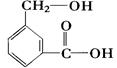
①请写出甲中所含官能团的名称 , 。
②甲在一定条件下跟Na反应的化学方程式是: 。
③甲跟NaHCO3溶液反应的化学方程式是: 。
Ⅱ、写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热: 。
(2)将CO2通入苯酚钠溶液中: 。
(3)1,3-丁二烯的与Br2的1、4加成反应: 。
(4)葡萄糖与银氨溶液发生银镜反应: 。
化合物H是重要的有机化合物,可由E和F在一定条件下合成:(有些反应条件省略如:加热等)
已知以下信息:
①A属于芳香烃,H属于酯类化合物。
②I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)B的结构简式 ,C的官能团名称 。
(2)B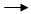 C;G
C;G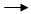 J两步的反应类型 , 。
J两步的反应类型 , 。
(3)①E+F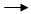 H的化学方程式 。
H的化学方程式 。
②I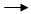 G的化学方程式 。
G的化学方程式 。
(4)H的同系物K比H相对分子质量小28,K的同分异构体中能同时满足如下条件:
①属于芳香族化合物
②能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。
K的一个同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式 。
不饱和酯类化合物在药物、涂料等领域应用广泛。由炔烃直接制备不饱和酯的一种新方法如下:反应①
(1)下列有关化合物Ⅰ~Ⅲ的叙述中,正确的是_ __。
| A.化合物Ⅰ能使酸性高锰酸钾溶液和溴水褪色 |
| B.化合物Ⅰ、Ⅱ、Ⅲ都能发生取代反应、加成反应、消去反应和加聚反应 |
| C.化合物Ⅰ的所有碳原子可能都处于同一平面上 |
| D.1mol化合物Ⅲ最多能与4molNaOH反应 |
(2)化合物Ⅲ的分子式为__________,1mol该化合物最多能与_____molH2完全反应。
(3)化合物Ⅳ是化合物Ⅲ的同分异构体,且满足以下条件,写出化合物Ⅳ结构简式___ (任写其中一种)
①能发生银镜反应,该化合物与银氨溶液反应的物质的量之比为1:4
②该化合物在与NaOH乙醇溶液共热能发生消去反应
③该化合物的核磁共振氢谱有四组峰,其峰面积比为6:2:2:1
④该化合物遇到FeCl3溶液显紫色
(4)化合物Ⅴ是用于制备高聚物 涂料的单体,化合物Ⅴ单体结构简式为______ 。该高聚物完全水解的化学方程式为 。利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 。
涂料的单体,化合物Ⅴ单体结构简式为______ 。该高聚物完全水解的化学方程式为 。利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 。
下图是一种合成 路线:
路线:
已知以下信息:
①有机化合物A可用来衡量一个国家石油化学工业发展水平。
②有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。
③
根据上述信息回答下列问题:
(1)A的结构式是 。
(2)B的结构简式为 。
(3)C生成D的化学方程式为 。
(4)反应Ⅱ的试剂是 ,该反应类型为 。
(5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有 种,所有这些同分异构体中,不同化学环境氢原子的种数 (填“相同”“不相同”)。
(每空2分,共10分)
I、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为:K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为 。
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。