类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论。以下几个类比推理结论中正确的是
| A.CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成 |
| B.在常温下,Na2CO3+2HCl=2NaCl+CO2↑+H2O,说明HCl酸性强于H2CO3;在高温下,Na2CO3+SiO2= Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3; |
| C.H2SO4为强酸,推出HClO4为强酸 |
| D.NH3的沸点高于PH3,推出CH4沸点高于SiH4 |
对于3Fe(s)+4H2O(g)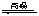 Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
| A.1/3 | B.1/6.75 | C.1/27 | D.1 |
反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / (L·s)B.υ(C)="0.5" mol / (L·s)
C.υ(B)=0.6 mol / (L·s)D.υ(A)=0.15 mol / (L·s)
下列说法或表示方法中正确的是()
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O (l)ΔH= +285.8kJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l)ΔH=" —53.7kJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ |
右图是某条件下 与
与 反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是
反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是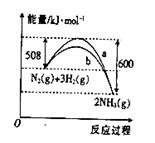
A.该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=+92kJ/mol 2NH3(g)ΔH=+92kJ/mol |
B.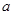 曲线是加入催化剂时的能量变化曲线 曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热数值会减小 |
D.反应2NH3(g)  N2(g)+3H2(g) ΔH=+92kJ/mol N2(g)+3H2(g) ΔH=+92kJ/mol |
下列热化学方程式中的反应热又为燃烧热的是
A. ══ ══  |
B. ══ ══  |
C. ══ ══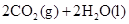  |
D. ══ ══  |