已知在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
| A.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH为4~5 |
| B.向溶液中通入Cl2,再通入NH3,调节pH为4~5 |
| C.向溶液中通入H2S使Fe2+沉淀 |
| D.加入纯Cu将Fe2+还原为Fe |
下列物质不能经过一步反应生成氯乙烷的是
| A.乙醇 | B.乙烯 | C.氯乙烯 | D.乙炔 |
1828年德国化学家维勒首次用无机物合成了有机物
| A.甲烷 | B.苯 | C.尿素 | D.乙醇 |
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A.baedc | B.edabc | C.abdce | D.cdeab |
下图是可逆反应X2 + 3Y2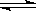 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
| A.t1时,只有正方向反应 |
| B.t2时,反应没有到达最大限度 |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度不再发生变化 |
对于可逆反应:2NO2 2NO+O2在恒定温度、体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在恒定温度、体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②正逆反应速率相等,反应停止了
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥v(NO2)正 = 2v(O2)逆
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |