(10分)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1 mol·L-1 500 mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答: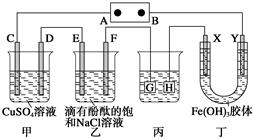
(1)若甲、乙装置中的各电极均只有一种单质生成时,对应各单质的物质的量之比为(按图中从左到右的顺序)_____________。
(2)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时,丙中镀件上析出银的质量为________,甲中溶液的pH是________。
(3)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是________。
(4)丁中X、Y两极附近的颜色变化情况是_________,产生这种现象的原因是________。
(8分,每空1分)下列各组物质:① O2和O3② H2、D2、T2③12C和14C④CH3OCH3和CH3CH2OH⑤乙炔和丁炔⑥淀粉和纤维素
其中(1)互为同系物的是,(填序号,序号不重复使用,下同)
(2)互为同分异构体的是,
(3)互为同位素的是,
(4)互为同素异形体的是,
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L层电子数是K层和M层电子数之和,C是所有短周期元素中半径最大的元素、C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应。试解答下列问题:
(1)B元素的简单离子的结构示意简图为
(2)A、D、E元素的名称分别为、、。
(3)E元素在周期表中的位置是第周期族。
(4)五种元素的简单离子半径从大到小的顺序是(用元素离子符号填写)
(5)五种元素中,得电子能力最强的是,失电子能力最强的是(填元素符号)
下表是元素周期表的前三周期:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 一 |
A |
|||||||
| 二 |
B |
C |
D |
E |
F |
|||
| 三 |
G |
H |
I |
J |
回答下列问题:
(1)写出下列元素的元素的符号:F______________、J_____________。
(2)G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
(5)将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。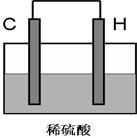
下列五种物质中,①Ar②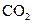 ③金刚石④
③金刚石④ ,⑤NaOH只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
,⑤NaOH只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
卤块的主要成分是MgCl2,此外还含有少量的Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁工艺以及相关数据如下: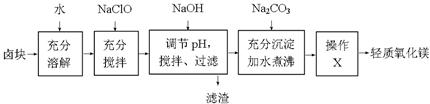
常温下生成氢氧化物沉淀的pH数据:
| 物质 |
开始沉淀时的pH |
沉淀完全时的pH |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
回答下列问题:
(1)加入NaClO后产生少量红褐色沉淀。写出加入NaClO后发生的离子反应方程式:_____________________。
(2)为尽量除去杂质,用NaOH调节pH。当溶液pH为________时,停止加入NaOH。
(3)流程图中操作X是_______________。
(4)加入Na2CO3后,加水煮沸的化学方程式为_________________________________。向除去Fe3+、Fe2+和Mn2+等离子后的滤液中改加Na2CO3,而不继续加入NaOH,你认为可能的原因是___________________ __。