短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(1~5小题每空2分,6小题3分,共17分)
以下是实验室常用的部分仪器,请回答下列问题
(1)序号为⑥和⑩的仪器的名称分别为________、________。
(2)在过滤操作中,必须用到上述仪器中的___(填序号),次外,上图中还缺少的玻璃仪器 (填名称)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)仪器上标有温度的是_______(填序号)。
(5)如图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是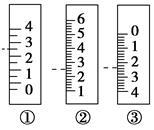
| A.①是量筒,读数为2.5 mL |
| B.②是量筒,读数为2.5 mL |
| C.③是滴定管,读数为2.5 mL |
| D.②是温度计,读数是2.5 ℃ |
(6)丙同学想用如图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。
按要求填空。
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__ ______。
(2)已知拆开1 mol H—H键、1 mol I—I分别需要吸收的能量为436 kJ、151 kJ,而形成1 mol H—I键会释放299 kJ能量。则由氢气和碘反应生成1 mol HI需要________(填“放出”或“吸收”)_______ __kJ的热量。
(3)S(g)+O2(g)=SO2(g) ΔH 1<0;S(s)+O2(g)=SO2(g) ΔH 2<0,比较ΔH1 __ ___ΔH2大小。
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g)  CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=________。
CO2(g)+H2(g)的平衡常数K2=________。
(2)已知在1 000 ℃时,该反应的平衡常数K3为1.0,则该反应为__ ______反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是_________。(填编号)
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(4)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正_______v逆(填“>”、“=”或“<”),该温度下反应达到平衡时,CO2的转化率为_________。
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为__ _____kJ。
依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为____________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol):_______。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) =N2O4(1) △H1= -19.5kJ·mol-1
②N2H4(1) + O2(g)=N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式_______。