不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 。
A.200 mL B.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为 ;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是 ;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)= ;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将 (填“偏大”、“偏小”或“无影响”)。
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题: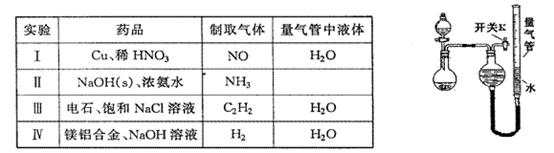
(1)如何检验如图所示装置的气密性:。
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?(填“可行”或“不可行”),原因是。
(3)实验Ⅲ烧瓶中发生反应的化学方程式是,打开开关K,产生的气体经验纯后点燃,现象是。
(4)实验Ⅱ中量气管中的液体最好是____(填字母编号,下同)
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有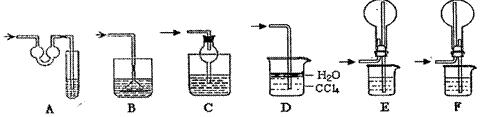
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②,③视线与凹液面最低处相平。
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10.0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为__。
DIS系统即数字化信息 系统,它由传感器、数据采集器和计算机组成,某研究性学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
系统,它由传感器、数据采集器和计算机组成,某研究性学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
⑴用_______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
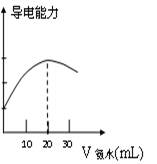
⑵量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(见左下图),向烧杯中滴加浓度为0.1000mol/L的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用_________润洗2~3遍,润洗的目的是____________。
②氨水与醋酸反应的离子方程式是_ ________________________
________________________ _________________。
_________________。
③食用白醋中醋酸的物质的量浓度是_____________。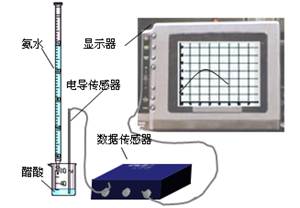
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱 样品,所用主要仪器是
样品,所用主要仪器是 。
。
(2)将样品配成250mL待测液,需要的仪器有。
(3)取10.00mL待测液,用量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时手旋转式滴定管的玻璃活塞,手不停地摇动锥形瓶,两眼注视,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度:。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。
|

 分的装置,则正确的操作
分的装置,则正确的操作 顺序是 (用操作编号填写)
顺序是 (用操作编号填写)
 水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;

(10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一配制醋酸溶液的浓度取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
配制250 mL 0.2 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和_________________。
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_______________________________________________________________________________
_____________________________________________ ____________________________________
____________________________________
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度____________。
(填增大、减小或不变)
实验三探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案_________________________
_____________________________________________。