用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱 样品,所用主要仪器是
样品,所用主要仪器是  。
。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点33℃,沸点:73℃。实验室可用如图装置制取ICl3。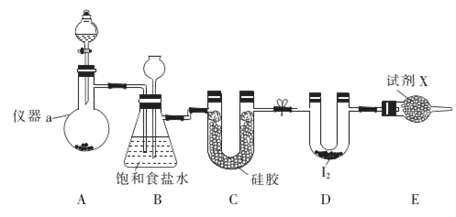
(1)仪器a 的名称是_____。
(2)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为_____________。
(3)装置B可用于除杂,也是安全瓶,能监侧实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:________。
(4)试剂X为___________
(5)氯气与单质碘需在温度稍低于70℃下反应.则装置D适宜的加热方式为__________。
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中,并加几滴酚酞指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
(1)正确的操作步骤是(填写字母): → → →D→ 。
(2)操作D中液面应调整到 ;开始E操作前须确保尖嘴部分 。
(3)以下操作会造成所测烧碱溶液浓度偏低的是 。
A.酸式滴定管未用待装溶液润洗
B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.在滴定前仰视,滴定后平视
F.滴定结束还有一滴挂在滴定管尖嘴外面
(4)该烧碱样品的纯度计算式是 (需化简)。
Ⅰ.下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。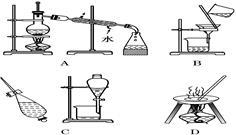
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)从碘水中提取碘____________________;
(2)分离酒精与水的混合物____________________;
(3)分离植物油和水____________________;
(4)除去粗盐中的泥沙制精盐____________________。
Ⅱ.实验室配制一定物质的量浓度溶液要用到量筒和图Ⅱ仪器等。
(1) 配制某浓度的稀硫酸,用10 mL量筒量取浓硫酸的体积如图Ⅰ所示, A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中浓硫酸的体积是________mL。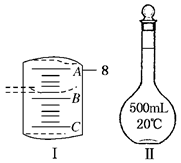
(2)要用CuSO4·5H2O晶体配制500mL 0.01mol/L CuSO4溶液,应该用托盘天平称取CuSO4·5H2O________g
(3)图Ⅱ所示仪器的名称是 ,若实验中图Ⅱ仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.仪器中有少量蒸馏水______________;
B.定容时加水超过刻度线______________;
C.最终定容时俯视观察液面______________。
(I)在课堂上,老师演示了金属钠在空气中燃烧的实验,观察仔细的同学发现生成产物的固体物质中除有淡黄色粉末外,还有黑色固体物质——碳。请你完成黑色固体物质产生的可能原因的猜想:
①__________________;②酒精不完全燃烧生成的碳;③酒精燃烧产生的二氧化碳(或空气中的二氧化碳)与金属钠反应生成的碳。
(II)八中科协化学兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入 纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置 A中有黑色固体和白色固体生成。
【资料卡片】
①K、Ca、Na 等活泼金属的氧化物均可与水反应生成对应的碱;
②钠为银白色金属,过氧化钠(Na2O2)为淡黄色固体。
【提出问题】白色固体含有什么物质?
【猜想与假设】
(1)假设 1:白色固体含有____________;
假设 2:白色固体含有Na2O。
【实验设计】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量白色固体放入足量水中 |
白色固体完全溶解 |
|
| (2)②取①中少量溶液于试管,加入___________ |
产生大量气泡 |
假设1成立 |
| (3)③另取①中少量溶液于试管,加入_________ |
______________ |
假设2成立 |
【反思提高】
(4)Na在CO2中燃烧存在多个反应、生成多种物质。请你写出其中生成物仅为一种白色固体与一种黑色固体的反应的化学方程式:_________________________。
实验室需要 0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有烧杯、玻璃棒、________。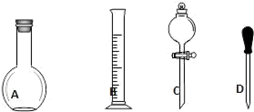
(2)在容量瓶的使用方法中,下列操作不正确的是
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线 1~2cm 处,用胶头滴管加蒸馏水至刻度线. |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线 1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算得知,需用量筒量取质量分数为 98%、密度为 1.84g/cm3的浓硫酸的体积为______mL,如果实验室有 15mL、20mL、50mL 量筒,应选用__________mL 量筒最好。
(4)根据计算用托盘天平称取 NaOH 的质量为_________g.在实验中其他操作均正确,若定容时仰视刻度线,则所配 NaOH 溶液浓度__________0.1mol/L(填“>”、“<”或“=”)。