(I)在课堂上,老师演示了金属钠在空气中燃烧的实验,观察仔细的同学发现生成产物的固体物质中除有淡黄色粉末外,还有黑色固体物质——碳。请你完成黑色固体物质产生的可能原因的猜想:
①__________________;②酒精不完全燃烧生成的碳;③酒精燃烧产生的二氧化碳(或空气中的二氧化碳)与金属钠反应生成的碳。

(II)八中科协化学兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入 纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置 A中有黑色固体和白色固体生成。
【资料卡片】
①K、Ca、Na 等活泼金属的氧化物均可与水反应生成对应的碱;
②钠为银白色金属,过氧化钠(Na2O2)为淡黄色固体。
【提出问题】白色固体含有什么物质?
【猜想与假设】
(1)假设 1:白色固体含有____________;
假设 2:白色固体含有Na2O。
【实验设计】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量白色固体放入足量水中 |
白色固体完全溶解 |
|
| (2)②取①中少量溶液于试管,加入___________ |
产生大量气泡 |
假设1成立 |
| (3)③另取①中少量溶液于试管,加入_________ |
______________ |
假设2成立 |
【反思提高】
(4)Na在CO2中燃烧存在多个反应、生成多种物质。请你写出其中生成物仅为一种白色固体与一种黑色固体的反应的化学方程式:_________________________。
现有一种简单可行的测定阿伏加德罗常数的方法,具体步骤为:⑴将固体NaCl细粒干燥后,准确称取m克NaCl固体并转移到定容仪器A中;⑵用滴定管向仪器A中加苯,不断振荡,继续加苯至A仪器的刻度处计算出NaCl固体的体积为Vml,请回答下列问题:
⑴步骤⑴中A仪器最好用
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
⑵步骤⑵中用酸式滴定管还是碱式滴定管,理由是;
⑶能否用水代替苯,理由是。
⑷已知NaCl晶体中,靠得最近的钠离子与氯离子间的平均距离为a cm,用上述方法测得的阿伏加德罗常数的表达式为
怎样通过实验来区别苯、己烷和己烯?写出简要的实验方法和有关反应的化学方程式。
以石灰石、焦炭、食盐和水为原料制取聚氯乙烯,写出各合成过程中有关的化学方程式。
50 mL 0.050 mol/L 盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中
进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
⑴从实验装置上看,图中尚缺少的一种玻璃仪器是 。
⑵大小烧杯间填满碎纸条的作用是 。
⑶大烧杯上如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”、或“无影响”)。结合日常生活的实际该实验该在 中进行效果更好。
⑷实验中改用60 mL 0.050 mol/L 盐酸与50 mL 0.55 mol/L NaOH溶液进行反应与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由 。
⑸用相同浓度、相同体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
(填“偏大”、“偏小”、或“无影响”);用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、或“无影响”)。
实验室可用硫化氢通人碘粉末的悬浊液制取一定浓度的氢碘酸。其主要装置如图所示,所用的试剂有:稀盐酸;用ott0法压成的硬方块形CaS;碘在水中的悬浊液;NaOH溶液;NaHS饱和溶液。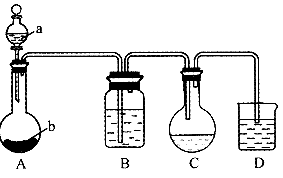
(1)在仪器中盛有的试剂:A中的a为,A中的b为,B为,D为。
(2)C中反应完全时,应呈现的现象是什么?
(3)D中的导气管末端是否应插入液面以下?请说明理由。
(4)氢碘酸在溶质的质量分数为57%时,可形成“恒沸点”溶液,在125~127℃沸腾出的蒸气中为57%的HI。试设计用C中液体制取57%的氢碘酸的主要方法。
(5)氢碘酸在空气中发雾,应保存于封得很严的暗色瓶中。为防止HI的氧化,在密封之前最好采用的措施是什么?(发挥你的创见)