实验室需要 0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有烧杯、玻璃棒、________。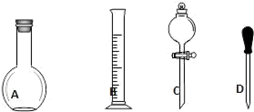
(2)在容量瓶的使用方法中,下列操作不正确的是
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线 1~2cm 处,用胶头滴管加蒸馏水至刻度线. |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线 1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算得知,需用量筒量取质量分数为 98%、密度为 1.84g/cm3的浓硫酸的体积为______mL,如果实验室有 15mL、20mL、50mL 量筒,应选用__________mL 量筒最好。
(4)根据计算用托盘天平称取 NaOH 的质量为_________g.在实验中其他操作均正确,若定容时仰视刻度线,则所配 NaOH 溶液浓度__________0.1mol/L(填“>”、“<”或“=”)。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应),某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定;
①按如图组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为__________________;
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为__________________;
(3)若将H2换成CO,则还需补充___________装置。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是__________________;
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、__________________;
(3)下列有关步骤⑥的操作中说法正确的是__________
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol•L-1KI溶液20.00ml,则铁矿石中铁的百分含量为________________;
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为_______________。
某研究性学习小组为探究二氧化硫的还原性,查阅到如下资料:
| 资料卡 NO:2006—KI—001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O=H2SO4+2HI |
根据上述资料,请你参与以下探究:
(1)写出铜与浓硫酸反应的化学方程式_____________________________;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是_____________________;
(3)证明SO2被氧化为SO42-所使用的试剂是______________;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是__(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是_______(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。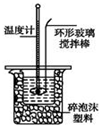
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: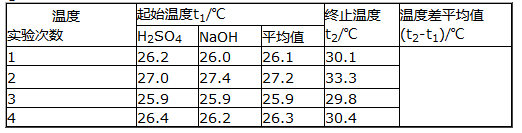
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 (填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液
则加入试剂的顺序是(填编号) 。
(2)Mg(OH) 2中加入盐酸后,要获得MgCl 2•6H 2O晶体,需要进行的实验操作依次 。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 .
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的离子方程式:
(5) 利用MgCl 2•6H 2O可制得无水氯化镁,应采取的措施是
(6) 用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
Ⅰ:用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)如果按图中所示的装置进行试验,求得的中和热数值 (填“偏大、偏小、无影响”)。(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与
(2)中实验相比,所求中和热_________ (填“相等”或“不相等”)。
Ⅱ: (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。已知:C3H8(g) ="==" CH4(g)+HC≡CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH3CH=CH2(g)="==" CH4(g)+ HC≡CH(g ) △H2="+32.4" kJ·mol-1
则C3H8(g) ="==" CH3CH=CH2(g)+H2(g) △H = kJ·mol-1。
(2)发射火箭时用肼( )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知 完全发生上述反应放出
完全发生上述反应放出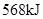 的热量,热化学方程式是: 。
的热量,热化学方程式是: 。