铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应),某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定;
①按如图组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为__________________;
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为__________________;
(3)若将H2换成CO,则还需补充___________装置。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是__________________;
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、__________________;
(3)下列有关步骤⑥的操作中说法正确的是__________
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol•L-1KI溶液20.00ml,则铁矿石中铁的百分含量为________________;
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为_______________。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有 、
、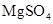 、
、 、
、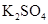 等4中溶液,可与实验中
等4中溶液,可与实验中 溶液起相似作用的是 ;
溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
|
|
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。

 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
⑴大小烧杯间填满碎泡沫塑料的作用___。
⑵(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响是(填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量(“增加”、 “减少”或“不变”),理由是;所求中和热数值(“增加”、 “减少”或“不变”),理由是。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。
实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。
(9分)在室温下,将表面积相同、纯度相同、体积也相同的同种锌片分别投入lOOmL、O.1mol/L的稀硫酸和0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异,投入到稀硫酸中的锌表面产生的气泡没有投人到稀盐酸中的快。大家分析、讨论后认为产生这一现象的原因可能有两个:氯离子对反应起了正的催化作用,即氯离子加快了反应;
另一种可能是硫酸根离子对反应起了负催化作用,即硫酸根离子阻碍了反应的进行。持前一种观点的三位同学设计实验并根据实验现象认为均证实了自己的推论是正确的,他们的实验方案和实验现象分别是:
甲:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投人lOOmL0.1mol/L的稀硫酸中,并加入适量氯化钠固体,发现反应速率加快;
乙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投入lOOmLO.1mol/L的稀硫酸中,并加入适量氯化锌固体,发现反应速率加快;
丙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投人lOOmLO.1moL/L的稀硫酸中,并加入适量氯化钡固体,发现反应速率加快;
请你对三位同学的实验方案作出评价,他们能否得出“氯离子对反应起了正的催化作用”的结论,并简要说出弹由.
甲:________;____________________________________________________________
乙:________;____________________________________________________________
丙:________;____________________________________________________________
(12分)(1)下列实验操作或对实验事实的叙述正确的是__(填序号)
| A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液。 |
| B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水。 |
| C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中。 |
| D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯。 |
E.多数有机反应很慢,往往需要加热,采用水浴加热易控制温度且受热均匀,石油分馏、苯和浓硝酸发生取代反应、银镜反应、油脂水解均必需水浴加热。
F.用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质。
(2)如右图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2S04并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。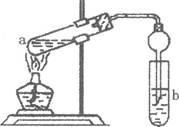
①加人浓H2S04的作用是______________________________________
②试管b中观察到的主要现象是_________________________________
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________________________
④饱和Na2C03溶液的作用是__________________________________