Ⅰ.下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
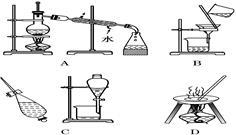
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)从碘水中提取碘____________________;
(2)分离酒精与水的混合物____________________;
(3)分离植物油和水____________________;
(4)除去粗盐中的泥沙制精盐____________________。
Ⅱ.实验室配制一定物质的量浓度溶液要用到量筒和图Ⅱ仪器等。
(1) 配制某浓度的稀硫酸,用10 mL量筒量取浓硫酸的体积如图Ⅰ所示, A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中浓硫酸的体积是________mL。
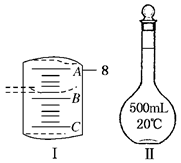
(2)要用CuSO4·5H2O晶体配制500mL 0.01mol/L CuSO4溶液,应该用托盘天平称取CuSO4·5H2O________g
(3)图Ⅱ所示仪器的名称是 ,若实验中图Ⅱ仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.仪器中有少量蒸馏水______________;
B.定容时加水超过刻度线______________;
C.最终定容时俯视观察液面______________。
某同学进行实验研究时,欲配制
溶液,但只找到在空气中暴露已久的
试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得
在283
、293
和303
时的溶解度(
/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物仅为
,理由是
(2)假设试剂由大量
和少量
组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时
饱和溶液的
=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、
溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,。 | |
| 步骤4: |
(3)将试剂初步提纯后,准确测定其中
的含量。实验如下:
①配制250
约
溶液:准确称取
克试样,置于烧杯中,加适量蒸馏水,,将溶液转入,洗涤,定容,摇匀。
②滴定:准确量取25.00
所配制
溶液于锥形瓶中,滴加指示剂,将(填"0.020"、"0.05"、"0.1980"或"1.5")
盐酸装入50
酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸
。
③ 计算
的质量分数=(只列出算式,不做运算)
(4)室温下,(填"能"或"不能") 配制
溶液。
甲、乙两同学为探究
与可溶性钡的强酸盐能否反应生成白色
沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中  产生白色沉淀,液面上放略显浅棕色并逐渐消失 产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入
, 停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是。
(2)C中白色沉淀是_,该沉淀的生成表明
具有性。
(3)C中液面上方生成浅棕色气体的化学方程式是_。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是;
乙在A、B间增加洗气瓶D,D中盛放的试剂是。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
高氯酸铵(
)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
 (1)若
用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是。
(1)若
用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是。
(2)反应得到的混合溶液中
和
的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多
晶体的实验操作依次为(填操作名称)、干燥。
(3)样品中
的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约
溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入
溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用
标准溶液滴定至终点,消耗
标准溶液
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml
溶液的玻璃仪器是。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是(填写步骤号)。
③为获得样品中
的含量,还需补充的实验是
是银锌碱性电池的正极活性物质,可通过下列方法制备:在
加入适量
溶液,生成
沉淀,保持反应温度为80,边搅拌边将一定量
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
+
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是.
(2)银锌碱性电池的电解质溶液为
溶液,电池放电时正极的
转化为
,负极的
转化为
,写出该电池反应方程式:.
(3)准确称取上述制备的样品(设
仅含和
)2.558
,在一定的条件下完全分解为
和
,得到224.0
(标准状况下)。计算样品中
的质量分数(计算结果精确到小数点后两位)。
实验室以含有
、
、
、
、
等离子的卤水为主要原料制备无水
和
,流程如下:
(1)操作Ⅰ使用的试剂是,所用主要仪器的名称是。
(2)加入溶液W的目的是。用
调节溶液Y的
,可以除去
。由表中数据可知,理论上可选择
最大范围是。酸化溶液Z时,使用的试剂为。
(3)实验室用贝壳与稀盐酸反应制备并收集
气体,下列装置中合理的是。
| A. |
a. |
| B. |
b. |
| C. |
c. |
| D. |
d. |
(4)常温下,
的电离常数
,
,
的电 离常数
,
。某同学设计实验验证
酸性强于
:将
和
气体分别通入水中至饱和,立即用酸度计测两溶液的
,若前者的
小于后者,则
酸性强于
。该实验设计不正确,错误在于。
离常数
,
。某同学设计实验验证
酸性强于
:将
和
气体分别通入水中至饱和,立即用酸度计测两溶液的
,若前者的
小于后者,则
酸性强于
。该实验设计不正确,错误在于。
设计合理实验验证
酸性强于
(简要说明实验步骤、现象和结论)。。仪器器自选。
供选的试剂:
、
、
、
、
、
、蒸馏水、饱和石灰水、酸性
溶液、品红溶液、
试纸。