FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入四氯化碳,操作 现象 |
假设1正确 |
| ②向溶液中另入 现象 |
假设2正确 |
若假设1正确,从实验①分离出Br2的实验操作名称是
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为
卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: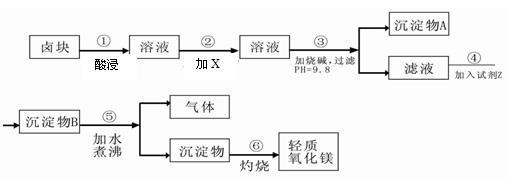
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2 ,30%) |
2400 |
| 烧碱(含98% NaOH) |
2100 |
| 纯碱(含99.5% Na2CO3) |
600 |
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
表2化学试剂价格表
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2,30%) |
2400 |
| 烧碱(含98%NaOH) |
2100 |
| 纯碱(含99.5%Na2CO3) |
600 |
(1)在步骤②中加入的试剂X,最佳的选择是,原因是。写出加入X发生反应的离子方程式。选择 (试剂)来检验Fe2+是否完全氧化为Fe3+
(2)在步骤③中控制pH=9.8,其目的是。
(3)试剂Z应该是。
(4)在步骤⑤中发生反应的化学方程式是。
(5)若在实验室中完成步骤⑥,则沉淀物必需在仪器A中灼烧。A应放置于仪器B上灼烧,灼烧完毕后应用仪器C取下仪器A置于仪器D上冷却。则B、C、D分别是、、。
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: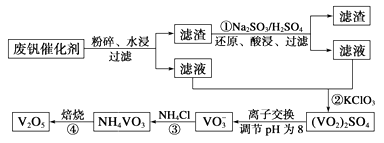
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式。
(2)图中所示滤液中含钒的主要成分为(写化学式)。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为、。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为VO2++H2C2O4+_____=VO2++CO2↑+H2O。
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+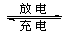 VO2++H2O+V3+,电池充电时阳极的电极反应式为。
VO2++H2O+V3+,电池充电时阳极的电极反应式为。
在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式。
(2)实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是(填序号字母)。
| A.酒精灯 |
| B.长直玻璃导管 |
| C.锥形瓶 |
| D.直型冷凝管 |
E.尾接管(接液管)
F.蒸馏烧瓶
G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是。
(3)肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1.黑色粉末是CuO;
假设2.黑色粉末是Fe3O4;
假设3.。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是。
②若所得溶液显血红色,则假设成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若产生现象,则假设3成立。
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。
| 物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
| 密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
| 熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
| 沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
| 在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):
常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
9.3 |
3.7 |
4.7 |
--- |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8.0 |
6.7 |
9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是______________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为_____________。
(4)试配平最后一步相关的氧化还原方程式:_____Na2Cr2O7 + ______SO2 + _______ H2O =" ______" Cr(OH)(H2O)5SO4 + ______ Na2SO4,每生成1mol Cr(OH)(H2O)5SO4时,该反应中转移的电子数为__________。