某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):
常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
9.3 |
3.7 |
4.7 |
--- |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8.0 |
6.7 |
9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是______________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为_____________。
(4)试配平最后一步相关的氧化还原方程式:_____Na2Cr2O7 + ______SO2 + _______ H2O =" ______" Cr(OH)(H2O)5SO4 + ______ Na2SO4,每生成1mol Cr(OH)(H2O)5SO4时,该反应中转移的电子数为__________。
某个同学分别做“探究加速度与力、质量关系”的实验。如图甲所示是该同学探究小车加速度与力的关系的实验装置,他将光电门固定在水平轨道上的B点,用不同重物通过细线拉同一小车,每次小车都从同一位置A由静止释放.
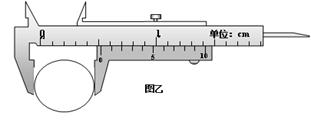
①若用游标卡尺测出光电门遮光条的宽度d如图乙所示,则d =cm;实验时将小车从图示位置由静止释放,由数字计时器读出遮光条通过光电门的时间∆t,则小车经过光电门时的速度为(用字母表示);
②测出多组重物的质量m和对应遮光条通过光电门的时间Δt,并算出相应小车经过光电门时的速度v,通过描点作出线性图象,研究小车加速度与力的关系。处理数据时应作出(选填“v—m”或“v2—m”)图象;
③若小车质量为M,AB间距离为L,小车运动的加速度为_________(请用可能用到的d、∆t、 m、M、L表示)
在“测绘小灯泡的伏安特性曲线”的实验中,用导线将a、b、c、d、e、f、g和h按图甲所示方式连接好电路,电路中所有元器件都完好,且电压表和电流表已调零。
(1)实验小组的同学首先测量并描绘出电源的路端电压U随电流I变化的图线如图乙中直线,则电源的电动势E= V,内阻r= Ω(保留两位有效数字);
(2)闭合开关后,若不管怎样调节滑动变阻器,小灯泡亮度都能发生变化,但电压表、电流表的示数总不能为零,则可能是 导线断路,某同学排除故障后测绘出小灯泡的U-I特性曲线为如图乙所示曲线,小灯泡的电阻随温度的上升而 ;
(3)将与上面相同的两个小灯泡并联后接到上面的电源上,如图丙所示,每一只小灯泡的实际电功率是 W(保留两位有效数字)。
现有毛玻璃屏A、双缝B、白光光源C、单缝D、透红光的滤光片E等光学元件,要把它们放在图1所示的光具座上组装成双缝干涉装置,用以测量红光的波长。

(1)将白光光源C放在光具座的最左端,从左至右,依次放置其他光学元件,表示各光学元件的字母排列顺序为C、____________、A。
(2)本实验的步骤有:
①调节单缝与双缝的间距为5cm~10cm,并使单缝与双缝相互平行;
②按合理顺序在光具座上放置各光学元件,并使各元件的中心位于遮光筒的轴线上;
③取下遮光筒右侧的元件,打开光源,调节光源高度,使光束能直接沿遮光筒轴线把屏照亮;
④用米尺测出双缝到屏的距离;用测量头(其读数方法同螺旋测微器)测量数条亮纹间的距离;
⑤将测得的数据代入公式求出红光的波长.
以上步骤合理的顺序是______________.(只填步骤代号)
(3)将测量头的分划板中心刻线与某条亮纹中心对齐,将该亮纹定为第1条亮纹,此时手轮上的示数如图2所示;然后同方向转动测量头,使分划板的中心刻线与第5条亮纹中心对齐,此时手轮上的示数如图所示. 则图2中手轮上的示数是________mm;图3中手轮上的示数是________mm.
(4)已知双缝到屏的距离为0.500m,使用的双缝间距为2.8×10-4m,由此可求得所测红光波长为λ=_____m。
有一额定电压为10V、额定功率在10~15W之间的用电器,小明同学想测定它的额定功率,实验室的工作人员提供了以下实验器材供其选用:
直流电源E一个(电动势为15V,内阻不计)
直流电压表V0一个(量程为0~3V,内阻为2kΩ)
直流电流表A0一个(双量程0~0.6~3A,内阻不计)
滑动变阻器一个:R阻(规格0~15Ω、1.8A)
定值电阻三个:R1="1" kΩ,R2="2" kΩ,R3="5" kΩ
单刀单掷开关1个,导线若干根。
(1)小明同学研究以后发现,电压表量程不能满足实验要求,为完成测量,他将电压表进行了“改装”:在电压表V0上串联一个或几个电阻,利用分压关系,以满足电表偏转的要求。若“改装”成量程为12V的电压表,在三个给定的定值电阻中应选用 ,将“改装”成的电压表内部结构电路图画在图甲方框中(标注出所用器材的符号)
(2)“改装”后的电压表用 表示,选好器材后,他设计了以下三个实验电路图,如图乙所示。你认为有没有一个合理的电路,如有,请将其还原成实验原理图,画在图丙方框内;如没有,请你帮他设计一个合理的电路,并将其画在图丙方框内。
表示,选好器材后,他设计了以下三个实验电路图,如图乙所示。你认为有没有一个合理的电路,如有,请将其还原成实验原理图,画在图丙方框内;如没有,请你帮他设计一个合理的电路,并将其画在图丙方框内。
(3)若该用电器正常工作时,电流表的指针如图丁所示,则它的额定功率为 W 。
如图所示的定滑轮装置,可以用来研究匀变速运动。钩码甲的质量大于乙的质量,两钩码运动过程中做匀加速运动。钩码甲带有遮光片。铁架台上有两个光电门A、B,与光电门相连的数字计时器(图中没有画出)能够自动记录下钩码甲在A、B之间运动的时间t。用刻度尺测出两个光电门A、B之间的距离h。改变光电门A的位置,测出6组不同的h与t对应数据(每次钩码甲都是从同一位置O由静止开始加速下落)。请回答以下问题: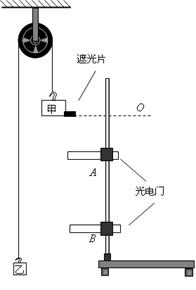
(1)设钩码加速度的大小a,钩码甲下落到B时速度v1,那么a、 v1、h、t之间的关系式是h= 。
(2)根据实验过程中得到的h与相对应t的6组实验数据,作出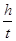 -t图线,如图所示,
-t图线,如图所示,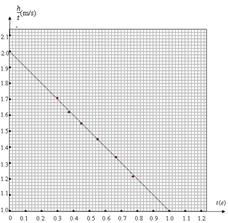
由图线可知,钩码运动的加速度a= m/s2;当钩码甲落至B位置时的速度v1= m/s。