下列说法正确的是
| A.氯化铁溶液有较强氧化性,故可用作净水剂 |
| B.煤中含有大量的有机物,用干馏的方法通过发生物理变化得到产物 |
| C.除去CH4中的少量C2H4:通过盛有酸性高锰酸钾溶液的洗气瓶 |
| D.将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于a g |
某溶液中,只可能含有下列离子中的几种:
| 阳离子 |
K+、Mg2、Fe3+、Al3+ |
| 阴离子 |
 、 、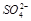 、 、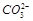 |
现每次取100.00mL溶液进行实验:①第一份加入硝酸银溶液有沉淀产生;②第二份加入足量氯化钡溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。下列说法错误的是()
A.C(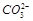 )="0.2" mol/L B.C(K+)一定为0.6mol/L
)="0.2" mol/L B.C(K+)一定为0.6mol/L
C.氯离子可能存在 D.一定有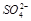 和
和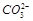
下列反应所得的溶液中一定只含一种溶质的是( )
| A.向硫酸酸化的Fe2(SO4)3溶液中加入过量的Ba(OH)2溶液 |
| B.向AlCl3溶液中加入过量的氨水 |
| C.向NaOH溶液中通人CO2气体 |
| D.将过量的Cu粉加入FeCl3溶液 |
下列反应的离子方程式正确的是( )
A.NH4HCO3溶液与过量KOH浓溶液共热:   |
B.用双氧水和稀硫酸处理印刷电路板: |
C.用FeS除去工业废水中的 |
D.足量的 通人Ca(ClO)2溶液中:Ca2++2C1O 通人Ca(ClO)2溶液中:Ca2++2C1O +SO2=====CaSO4↓+2C1 +SO2=====CaSO4↓+2C1 |
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为()
| A.1.0g | B.2.0g | C.2.5g | D.3.5g |
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解l9.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示。下列分析或结果错误的是()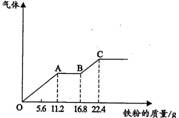
A.原混合酸中NO 物质的量为0.2mol 物质的量为0.2mol |
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+====3Fe2+,BC段产生氢气 | C.第二份溶液中最终溶质为FeSO4 | D.H2SO4浓度为2.5mol·L-1 |