(16分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)已知化合物C含有下述元素中的某一种元素
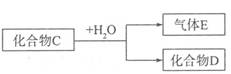
①若D是一种强酸,则C与水反应的化学方程式为 。
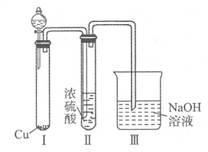
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图装置进行实验.分液漏斗中应加入 ,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是 。
②若D是一种常见的强碱,则C与水反应的离子方程式为 。
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:_____________。
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为______________。
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为SO42-,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为____________________。
常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=____________。
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为___________;电解过程中阴极区溶液的pH______________(填“变大”、“变小”或“不变”)。
0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为 。若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于 烃,结构简式为 ,名称是 。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示:
(1) 下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
| A.CH3CH3 | B.CH3COOH |
| C.CH3COOCH3 | D.CH3OCH3 |
(2) 化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为: ,请预测B的核磁共振氢谱上有 个峰(信号)。
(3)用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是 。
下列各化合物中,属于同系物的是 ,属于同分异构体的是 (填入编号)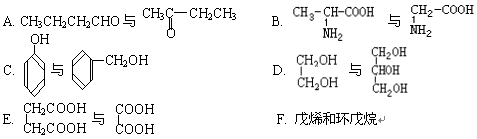
用系统命名法命名下列有机物:
(1)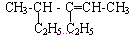 ________________________
________________________
(2)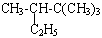 ______________________________________________
______________________________________________