(14分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。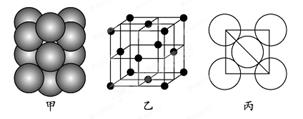
(15分)汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)△H1
4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)△H2
2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H1、△H2、△H3三者关系式为 。
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) : n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) : n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的5L容器中,10分钟达到平衡,则NO2的化学反应速率为 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1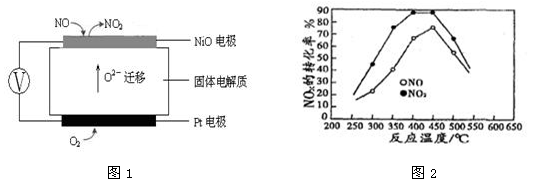
①NiO电极上NO发生的电极反应式 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中n(NO)︰n(NO2)= 。
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃—450℃时,NOx转化率随温度升高而增大,450℃—600℃时NOx转化率随温度升高而减小
结论二的原因是 。
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂
B.降低温度
C.分离出H2O(g)
D.增大压强
E.增加原催化剂的表面积
F.减小投料比[n(NO2) : n(CH4)]
(共10分)乙烯是一种用途广泛的基本有机化工原料,可以用来合成碳酸二甲酯(DMC)等重要化工产品(部分反应条件已略去):
已知:ⅰ、羟基直接与碳碳双键相连不稳定:R—CH=CH—OH→R—CH2—CHO
ⅱ、1mol化合物C与足量银氨溶液反应生成4mol单质银
(1)工业上生产乙烯的主要方法是 ,试剂X为 。
(2)下列说法正确的是 。
A.D→E的反应类型为取代反应
B.化合物A与化合物C含有相同官能团
C.DMC与乙酸乙酯互为同系物
D.DMC酸性条件下水解能产生CO2和甲醇
(3)写出B→C的化学反应方程式 。
(4)现代工业也常用尿素( )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 。
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 。
【化学—选修5有机化学基础】可降解聚合物P的制取路线如下
(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是_____________。
(4)化合物D苯环上的一氯代物有2中,D的结构简式是 。
(5)E→F中反应①和②的反应类型分别是___________。
(6)F的结构简式是___________。
(7)聚合物P的结构简式是 。
[化学—选修3:物质结构与性质](15分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。F是第四周期元素,F原子的基态电子排布中有4个未成对电子;
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,C元素的气态氢化物的VSEPR模型为 。B2A4是重要的基本石油化工原料,1 mol B2A4分子中含__________molσ键。
(4)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(5)已知D、E能形成晶胞如图所示的两种化合物,
化合物的化学式,甲为__________,乙为___________;高温时,甲易转化为乙的原因为_____________。
【选修5—有机化学基础】有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M.与NaOH溶液反应后的产物,其一氯代物只有一种。
请回答:
(1)B、F的结构简式分别为____________、____________
(2)反应①〜⑦中,属于消去反应的是________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________;反应⑦的化学方程式为__________________。
(4)A的相对分子质量在180〜260之间,从以上转化中不能确认A中的某一官能团,确 定该官能团的实验步骤和现象为________________________________________。
(5)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6