(12分)硫的化合物在工业上有广泛的应用,因此研究硫的化合物制备有着重要的意义。某同学拟采用下图装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5)。
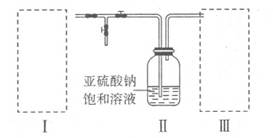
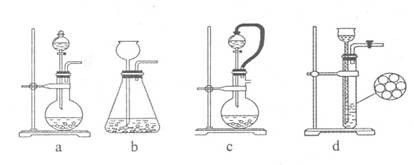
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为 。如果想控制反应速度,下图中可选用的发生装置是 (填写字母)。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是 ;某同学需要480 mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为 ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
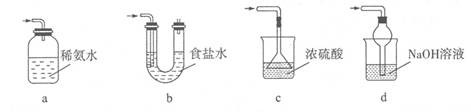
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
浓硫酸与木炭粉在加热条件下反应:C+2H2SO4(浓) CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
Ⅰ、第一小组用下图所示各装置设计一个实验,验证上述反应所产生的三种产物。 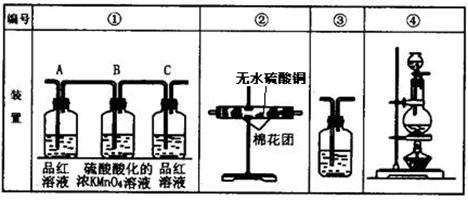
(1)这些装置的连 接顺序(按产物气流从左到右的方向)是(填装置的编号):
接顺序(按产物气流从左到右的方向)是(填装置的编号): ④ →__________→__________→__________。
④ →__________→__________→__________。
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液变化体现了SO2 性,B瓶溶液反应是利用SO2 性。
B瓶溶液的作用是 ,
C瓶溶液的作用是 。
(3)实验时装置②中看到现象是 。
(4)装置③中所加的试剂名称是 ,现象是 。
Ⅱ、另一小组为测得CO2和SO2的质量,并算两者物质的量比,设计下列实验:
将生成气体依次通过X溶液→浓硫酸→碱石灰1→碱石灰2,并设法让气体完全被吸收。
(1)下列试剂中可以充当X的是: ( )
| A.BaCl2溶液 | B.Ba(OH)2溶液 |
| C.滴加H2O2的BaCl2溶液 | D.滴加H2O2的Ba(OH)2溶液 |
(2)实验结束后,在X溶液中得到的沉淀通过过滤、洗涤、烘干、称重,称得质量为ag。称得碱石灰1在实验前后 增重质量为bg。用a、b表示CO2和SO2的物质的量比 。
增重质量为bg。用a、b表示CO2和SO2的物质的量比 。
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。该反应的离子方程式为________________________________________________。
提出合理假设。该实验中反应速率明显加快的原因可能是__________。
| A.反应放热导致温度升高 | B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验编号 |
铜片质量/g |
0.1mol·L-1的硝酸体积/mL |
硝酸铜晶体/g |
亚硝酸钠晶体/g |
实验目的 |
| ① |
5 |
20 |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
||
| ② |
0.5 |
a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250 mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了的弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。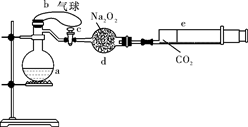
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中 ),则可观察到的现象是 。(2分)
),则可观察到的现象是 。(2分)
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。
①若用加入化学试剂法,下列试剂中可以选用的是 。
| A.蒸馏水 | B.无水醋酸钠 |
| C.石墨 | D.少量硝酸银溶液 |
②将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是4NO2+O2+2H2O===4HNO3或4NO+3O2+2H2O===4HNO3 ,此时气球是全在烧瓶外还是一部分进入烧瓶 。
③打开弹簧夹,将二氧化碳反推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL。
④将上述全过程用一个总的化学方程式表示: 。
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题: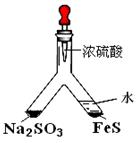
(1)实验目的:验证SO2有氧化性。
将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,在支管交叉处实验现象为__________________________________;
硫化亚铁处加水的目的是____________________________。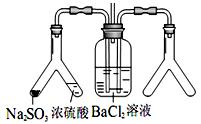
(2)实 验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。
验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。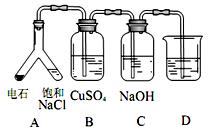
(3)实验目的:探究电石气中的成分。
①装置 A中发生的主要化学反应方程式为:___________________________。
② B装置中出现黑色沉淀,C 装置的作用为__________。
③为验 证电石气的主要成分,D中盛放______________。
证电石气的主要成分,D中盛放______________。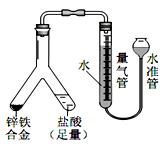
(4)实验目的:锌铁合金中铁含量的测定
①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________________。
②若称得锌铁合金的质量为 0.117g,量气管中初读数为 1. 00mL,末读数为 45.80mL,则合金中铁的含量为_____%(保留2 位小数,已折算标况)。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ①[ |
制备氧气 |
H2O2→O2 |
|
| ② |
制备氨气 |
NH4Cl→NH3 |
|
| ③ |
制 备氯气 备氯气 |
HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是(填气体名称,下同);从反应原理看,明显不同于其他两种气体的是。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编 号填入上表中的空格中。
号填入上表中的空格中。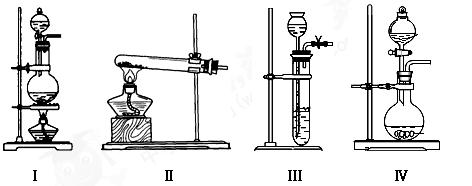
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质: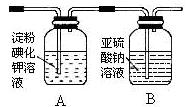
①通入氯气后,A中的现象是,整套实验装置存在的明显缺陷是。
②请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化:
(4)若用排空气法收集Cl2,在下边方框内画出气体收集装置图。
(5)若将多余的Cl2用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知其pH等于13 (不考虑反应前后溶液的体积变化),ClO-和ClO3-的物质的量浓度之比为5∶1。则在整个过程中被氧化的氯气的物质的量为 mol。
mol。