氯气在生产生活中应用广泛。
(1)多余的氯气可用NaOH溶液吸收,反应的离子方程式为 。工业上也可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的离子方程式 。
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤I中,试剂甲必须具有的性质是 (填序号)。
A.氧化性 B.还原性 C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为 。
(3)用100 mL 12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为 。
根据右图物质之间的转化关系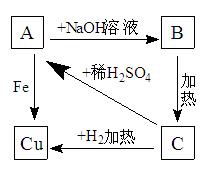
回答:
1)写出A、B、C的化学式:A;B;C。
2)写出下列各步的化学反应方程式:
A→B:;
A→Cu: 。
1)标准状况下,112mL某气体的质量为0.14g,则其相对分子质量为。
2)1. 56g可以显+1价的某金属与足量盐酸完全反应,生成0.04g氢气,则该金属的摩尔质量为。
56g可以显+1价的某金属与足量盐酸完全反应,生成0.04g氢气,则该金属的摩尔质量为。
等质量的氧气和臭氧(O3),它们的物质的量之比为,标准状况下的体积比为,原子的个数比为,标准状况下的密度之比为。
1)6.02×1024个Na+约含mol Na+,其质量为g;
2)4.5molCH4约含有个CH4,其质量为g;
3)3.01×1023个SO42-约含molSO42-,其质量为g;
4)49gH2SO4约含有个H,共含有mol原子。
有下列物质:①Cu ②H2SO4 ③蔗糖  ④Fe(OH)3 ⑤SO2 ⑥NaHCO3 ⑦(NH4)2SO4 ⑧K2O(用序号作答)。
④Fe(OH)3 ⑤SO2 ⑥NaHCO3 ⑦(NH4)2SO4 ⑧K2O(用序号作答)。
1)按组成进行分类,酸有  ,碱有 ,盐有 。
,碱有 ,盐有 。
2)上述十种物质中,其中属于电解质的有 ,属于非电解质的有 。