研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。
已知:①2R-COOH + 2Na → 2R-COONa + H2 ↑
②R-COOH + NaHCO3 → R-COONa + CO2↑ + H2O
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为 。] |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有 种氢原子。 综上所述, A的结构简式为 。 |
(10分)Ⅰ、可逆反应:aA(g) + bB(g)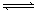 cC(g) + dD(g);根据图回答:
cC(g) + dD(g);根据图回答: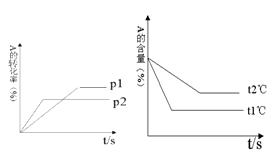
①压强 P1P2;(a +b)(c +d)(填“>”或“<”下同)。
②温度t1℃t2℃;△H0。
③保持体积和温度不变,通入He,平衡会____移动(填“正向”、“逆向”或“不”)。
Ⅱ、写出下列元素基态原子的电子排布式:
①29Cu
②32Ge(简式)
(11分)(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)相同物质的量浓度的Na2CO3溶液与NaHCO3溶液,pH大小:Na2CO3________NaHCO3(填“>”、“=”或“<”)。
(3)在配制FeCl3溶液时,应加入__________,目的是_____________。
(4)Na2S溶液中滴入酚酞溶液显______色,原因是__________________。(用离子方程式表示),
(5)将氯化铝溶液蒸干并灼烧得到的固体物质是;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是。
(10分)Ⅰ、在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
①A中反应的离子方程式为:_______________________________。
②B中Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
Ⅱ、如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: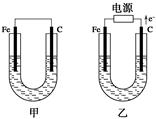
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①甲池中碳棒上电极反应式是_____________________,
②乙池电解一段时间后,测知溶液体积为200ml,PH=13,则阴极生成的气体在标准状况下体积是______L。
有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH中的一种或几种,为证明其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是,原混合物中一定不含有;
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。则原混合物中一定含有。 该反应的离子方程式为;
(3)将实验(1)中得到的滤液分成两份,将实验(2)中产生的无色气体先通入其中的一份,无沉淀产生。气体导出后再通入另一份滤液中,立即产生白色沉淀,再过滤。出现上述现象的原因是实验(2)中产生的气体里含有 。
(4)向实验(3)中过滤后所得的滤液里加入AgNO3溶液和稀硝酸,又产生白色沉淀,根据此现象推断,原混合物中一定还含有,根据实验全过程推断,原混合物中还含有。
某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果: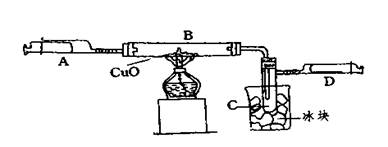
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是mol;
(2)在实验中看到的现象是。
(3)B中反应的化学方程式是。