某同学设计了如下图所示的装置进行电化学实验,请你根据装置图回答相关问题:
(1)C池属于什么装置 。
(2)电极②上发生电极反应式为 ;B池中发生的总反应方程式为 。
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是________。
(4)当电路上有0.2 mol电子流过时,电极④上质量变化______g, 电极⑥上质量变化______g。
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3 g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
(2)该结晶水合物的化__________________________________________________.
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5 mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
写出除去下列物质中的杂质(括号内为杂质)时发生反应的化学方程式:
(1)Na2CO3固体(NaHCO3);
(2)SiO2(Al2O3)。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: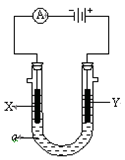
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为,在X极附近观察到的现象是。
② Y电极上的电极反应式为,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。(说明:杂质发生的电极反应不必写出)
(12分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________;
(2)若电解质溶液为硫酸,其正极反应为______________________,负极反应为_________________;若在常温下转移2mol电子,可产生水质量为_________g。
(3)还有一个很大的优点是。
(6分)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
在空气酸度不大的环境中,其负极是,负极反应式为;
正极是,正极反应式为。