根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4 |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- |
Cl2、Mn2+ |
A.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
B.第①组反应的氧化产物为O2
C.第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
D.第③组反应中生成1mol Cl2,转移电子2mol
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是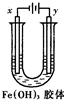
| A.x是阳极,y是阴极 |
| B.x极附近颜色变深,y极近颜色变浅 |
| C.x是阴极,y极附近颜色加深 |
| D.y是阴极,x极附近颜色加深 |
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径A2->C->B2+
B.它们的原子半径C>B>A
C.它们的原子序数A>B>C
D.原子最外层上的电子数C>A>B
常温下,在pH=13的无色溶液中,可以大量共存的一组离子是
| A.Na+、SO32-、AlO2-、NO3- |
| B.CO32-、NO3-、HCO3-、Na+ |
| C.NH4+、NO3- 、K+、SO42- |
| D.MnO4-、K+、Na+、SO32- |
下列有关化学实验的说法中正确的是
| A.烧杯、坩埚、试管、锥形瓶都可以用酒精灯直接加热 |
| B.银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热 |
| C.制取氨气、氢气时都可以用向下排空气法收集 |
| D.石油的分馏、实验室制取乙炔和制取蒸馏水都要用到冷凝装置 |
下列反应的离子方程式正确的是
| A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3- |
| C.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+ |
| D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |