2SO2(g)+ O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH =" -" 99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH =" -" 99 kJ·mol-1
请回答下列问题:
(1)图中A表示_____________________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________。
(2)图中ΔH =" __________" kJ·mol-1。
(3)如果反应速率v(SO2)为0.06 mol·L-1·min-1,则v(O2)为__________ mol·L-1·min-1。
(4)已知S(s) + O2(g) = SO2(g) ΔH =" -" 296 kJ·mol-1,则由S(s)生成5 mol SO3(g)的ΔH= kJ·mol-1。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
则,A的化合价 ▲ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),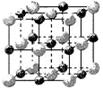
其中3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: ▲ ,原因是: ▲。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)某配合物的分子结构如右图所示,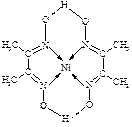
则N原子的杂化方式为 ▲ ;基态Ni原子的电子排布式 ▲ 。
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。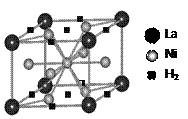
① Ni原子的价电子排布式是▲。
② 该合金储氢后,含1mol La的合金可吸附H2的数目为▲。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是▲。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是▲。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是▲,其中心原子N的杂化方式是▲。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)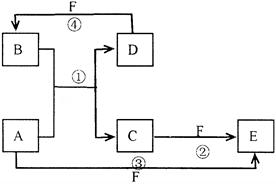
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,
则A的原子结构示意图为__________,反应④的化学方程式为④.
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________ .
.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,分子E的结构式为__________
(8分) 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它能发生如下反应:3NF3+5H2O===2NO+HNO3+9HF。请回答下列问题:
⑴NF3中氮元素的化合价为;
⑵NF3的大于HNO3(填氧化性或还原性);
⑶在上述反应中还原剂与氧化剂的物质的量之比为;
⑷若生成0.2 mol HNO3,则转移的电子数为;
10分)写出下列反应的离子方程式
⑴电解饱和食盐水
⑵铝与氢氧化钠溶液反应
⑶碳酸氢钠溶液中滴入少量的氢氧化钙溶液
⑷加热次氯酸钠浓溶液与浓盐酸的混合液
⑸在溴化亚铁溶液中通入过量的氯气