能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。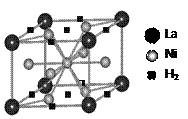
① Ni原子的价电子排布式是 ▲ 。
② 该合金储氢后,含1mol La的合金可吸附H2的数目为 ▲ 。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是 ▲ 。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是 ▲ 。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是 ▲ ,其中心原子N的杂化方式是 ▲ 。
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)N、O、S三种元素的第一电离能大小顺序为: > > 。(填元素符号)
(2)已知水的沸点远高于H2S,这是由于 。
(3)某晶体的晶胞如右图所示,X位于体心,Y位于4个面心,Z位于8个顶点,该晶体中 X、Y、Z的粒子个数比为 。
(4)Cu2Cl2·2CO·2H2O是一种配合物,其结构如右图所示:
①与CO为互为等电子体的分子是 。
②该配合物中,氯离子的杂化方式为 ;
金属阳离子的核外电子排布式为 。
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。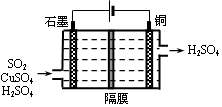
【化学与技术】
从海水中提取一些重要的化工产品的工艺流程如图所示。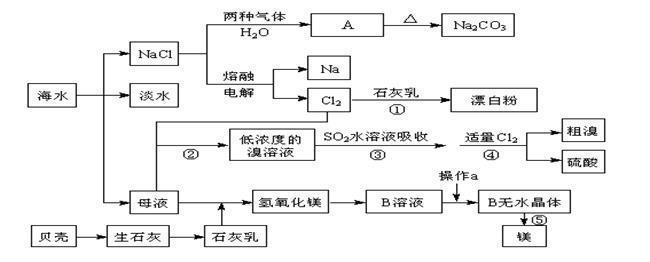
根据上述流程图回答下列问题:
(1)图中A的化学式为________________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为_____________________。( 2分)
(2)海水淡化处理的方法有______________________________。(写出3种即可)( 3分)
(3)过程⑤的化学方程式为__________________________________________。( 2分)
(4)从B溶液制备B的无水晶体的“操作a”为_______________________________ 。( 2分)
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式 _____________________________。( 2分)
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是____________。( 2分)
【离子推断】某混合溶液中,只可能大量含有下表所列离子中的某几种:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
OH-、SO42-、CO32-、AlO2-、S2- |
将Na2O2逐渐加入到上述混合溶液中,产生沉淀的物质的量与加入Na2O2的物质的量的关系如图所示。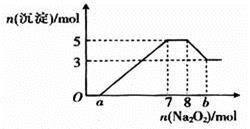
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加)。(每空1分)
| 离子种类 |
||||||
| 物质的量(mol) |
(2)图中a=____________, b=____________。
食用明胶是水溶性蛋白质混合物,具有很高的营养价值,溶于水形成胶体。而工业明胶中往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成________。
(3)明胶的水溶液和K2SO4溶液共同具备的性质是___________。
a.都不稳定,密封放置沉淀
b.两者均会发生丁达尔效应
c.分散质微粒可通过滤纸
(4)已知胶体的分散质微粒不能透过半透膜,但小分子或离子能透过半透膜。现将10 mL明胶的水溶液与5 mL NaBr溶液混合后装入半透膜袋内,将此半透膜袋浸入盛蒸馏水的烧杯中。若要求只检验一种离子, 就能证明Na+、Br-透过半透膜,写出检验该离子的实验方法:______________________
(5)铬的化合价除了+3和+6价外,还有0,+2,+4和+5价等。现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为____________价。