反应N2O4(g) 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。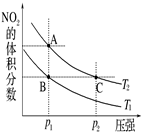
下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
有三个热化学方程式:① 2H2 (g) + O2 (g) = 2H2O (g) ;ΔH1= Q1 kJ/mol;② 2 H2 (g) + O2 (g) =" 2" H2O (l) ;ΔH2 =Q2 kJ/mol;③ H2 (g) + 1/2 O2 (g) = H2O (g) ;ΔH3= Q3 kJ/mol;其中Q1、Q2、Q3的大小关系为
| A.Q1 = Q2 = Q3 | B.2Q3 = Q1 < Q2、 |
| C.Q3 < Q2 < Q1 | D.Q2< Q1< Q3 |
一定温度下,可逆反应3X(g)+Y(g)  2Z(g)达到限度的标志是
2Z(g)达到限度的标志是
| A.X、Y、Z的分子个数比为3:1:2 |
| B.X的生成速率与Z的生成速率相等 |
| C.X、Y、Z的浓度相等 |
| D.单位时间内生成3n mol X,同时消耗n mol Y |
在一定温度下,将CO和水蒸汽各1mol放在密闭容器中反应: ,达平衡后测得
,达平衡后测得 为0.6mol,再通入4mol水蒸汽,达新的平衡后,
为0.6mol,再通入4mol水蒸汽,达新的平衡后, 物质的量
物质的量
| A.等于0.6mol | B.等于1mol |
| C.大于0.6mol,小于1mol | D.大于1mol |
下列各组性质比较中,正确的是
①失电子能力: K>Na>Li②碱性: CsOH > KOH > NaOH
③氧化性:F>Si>O④稳定性:PH3 <H2S<HCl
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是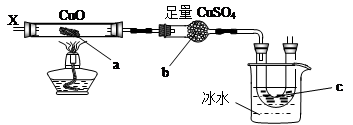
| A.H2 | B.NH3 | C.CH3CH2OH(气) | D.CO和H2 |