(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)  2NO2 (g) △H > 0,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
2NO2 (g) △H > 0,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
(1)该温度时,该反应的平衡常数为 。
(2)a、b、c、d四个点中,化学反应处于平衡状态的是 点。
(3)25 min时,增加了 mol (填物质的化学式)使平衡发生了移动。
(4)d点对应NO2的物质的量浓度 (填“>”、“<”或“=”)0.8 mol·L–1,理由是 。
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)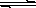 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
(8分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、加热分解C、结晶法D、分液法E、蒸馏法F、过滤法
(1)分离饱和食盐水和沙子的混合物;
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)分离水和苯的混合物;
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)
(10分)
⑴微粒AXn-核外有18个电子,则它的核电荷数为,核内中子数为。
⑵由1H216O与2H217O所代表的物质中,共有种元素,种原子,
16O、17O的关系为。(填同位素或同种原子或同种核素)
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CC14、苯等有机溶剂。固态Ni(CO)4
属于____晶体,基态Ni原子的电子排布式为;
| A.氢键 | B.离子键 | C.共价键 | D.配位键 |
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 等,其中碳原子采取sp2杂化的分子有(填物质序号),预测HCHO
等,其中碳原子采取sp2杂化的分子有(填物质序号),预测HCHO
分子的立体结构为形;
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶
胞面上,镧原子都在晶胞顶点。则该晶体的化学式为。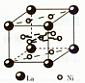
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O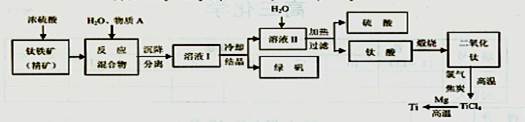
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由;
(3)上述生产流程中加人物质A的目的是防止Fe2+被氧化,物质A是____,上述制
备TiO2的过程中,所得到的副产物及可回收利用的物质是。
(4)钛、氯气和过量焦炭在高温下反应的化学方程式;
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数____(用A、B字母表示)。