已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况)为11.92g/L。有关氯化铝的叙述中错误的是
| A.氯化铝是共价化合物 |
| B.氯化铝的化学式应为Al2Cl6 |
| C.氯化铝的结构式如图:分子结构中有配位键 |
| D.在一定条件下,将AlCl3晶体加热至融化,熔融态的AlCl3可以导电 |
胡椒酚是植物挥发油的成分之一,它的结构简式为:HO- -CH2CH=CH2,下列叙述中正确的是
-CH2CH=CH2,下列叙述中正确的是
| A.1mol胡椒酚最多可与4molH2发生反应 |
| B.1mol胡椒酚最多可与4mol溴发生反应 |
| C.胡椒酚中所有原子可以共平面 |
| D.胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是
| A.加入金属钠 | B.利用质谱法 |
| C.燃烧法 | D.利用核磁共振氢谱仪 |
化学与生活密切相关,下列说法正确的是
| A.福尔马林可用于保存海鲜产品 |
| B.鸡蛋清中加入CuSO4溶液会发生变性 |
| C.合成橡胶与光导纤维都属于有机高分子材料 |
| D.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |
NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol苯分子中含有碳碳双键的数目为3NA |
| B.2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA |
| C.1mol—OH中电子数目为10NA |
| D.标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
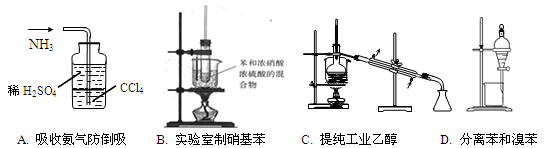
下列实验目的不能实现的是