氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。氯碱工业中制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。学校实验小组精制粗盐水的实验过程如下: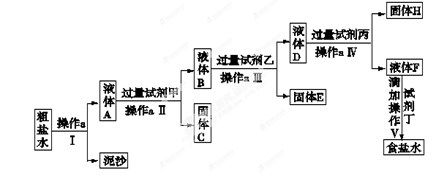
请回答以下问题:
(1)操作a的名称是 ,所用玻璃仪器是 。
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为 溶液。
(3)判断加入试剂乙已过量的方法是 。
(4)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式 。
(8分)非金属单质及其化合物在生产和科研中都有重要应用。
(1) 若发生大量氯气泄漏事故,下列措施中正确的是_________。
a.立即通报相关部门,迅速撤离事故现场
b.用蘸有肥皂水的毛巾捂住口鼻立即逆风疏散
c.用蘸有NaOH溶液的毛巾捂住口鼻立即顺风疏散
(2) 事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是________。
(3) 向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是__________
(4) Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入C12的物质的量,纵坐标是反应后气体物质的量总和。已知所取C12、NO2的物质的量总和为6 mol。则生成物的化学式是__________。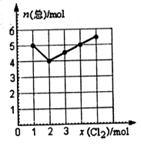
粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4% ,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+3Na2CO3→2NaAlSiO4+4NaAlO2+3CO2↑ ①
Al6Si2O13+5Na2CO3→2Na2SiO3+6NaAlO2+5CO2↑②
SiO2+Na2CO3→Na2SiO3+CO2↑③
(1)粉煤灰中铝的质量分数为%。
(2)用l mol Al6Si2O13和4mol SiO2制得5mol NaAlO2、lmolNaAlSiO4,还应制得Na2SiO3 mol,共消耗Na2CO3mol(得到的固体中无SiO2)。
(3)若粉煤灰中Al6Si2O13与SiO2的物质的量之比为1:2,则1妇粉煤灰与6molNa2CO3反应(反应物全部都参与反应),可制得NaAlO2 mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2)=x,消耗Na2CO3 ymol,试确定y与x的关系式。
白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、si、H的氧化物表示、。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为g/mol。
(2)另取4.05g白玉粉末加入lmol/L的盐酸100mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则①p= ;②白玉的化学式为。
;②白玉的化学式为。
2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。
如图表示两个丙烯分子进行烯烃复分解,生成两个新的烯烃分子:2一丁烯和乙烯。
现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
(1)反应①的类型:反应;反应⑥的类型:反应
(2)G的结构简式:;反应⑩的反应条件:
(3)反应②的化学方程式是;
(4)反应④中C与HCl气体在一定条件只发生加成反应,反应④ 和⑤不能调换的原因是,E的结构简式:;
和⑤不能调换的原因是,E的结构简式:;
(5)反应⑨的化学方程式:。
化学式为C8H10O的化合物A具有如下性质:
①A+Na→慢慢产生气泡
②A十RCOO 有香味的产物
有香味的产物
③A 苯甲酸
苯甲酸
④其催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应中可制得一种塑料制品(它是目前主要的“白色污染”源之一。)
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是(多选扣分)
| A.苯环上直接连有羟基 |
| B.肯定有醇羟基 |
| C.苯环侧链末端有甲基 |
| D.肯定是芳香烃 |
(2)化合物A的结构简式。
(3)A和金属钠反应的化学方程式。
(4)A的脱水反应化学方程式。