(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
巨豆三烯酮(F)是一种重要的香料,其合成路线如下: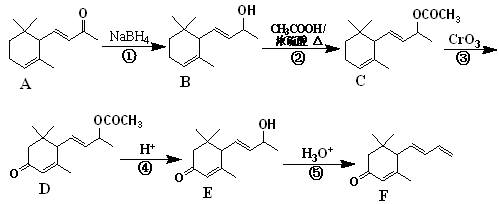
(1)化合物F的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2。
(2)在上述转化过程中,反应②的目的是,写出反应②的化学方程式为 。
(3)下列说法正确的是 (双选,填字母)。
A.化合物A ~ F均属于芳香烃衍生物
B.反应①属于还原反应
C.1 mol 化合物D可以跟4 mol H2发生反应
D.化合物F含有的官能团名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式为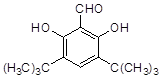 ,请写出另外一种同分异构体的结构简式。
,请写出另外一种同分异构体的结构简式。
A.属于芳香族化合物;
B.核磁共振氢谱显示,分子中有4种化学环境不同的氢原子;
C.1mol该物质最多可消耗2molNaOH
D.能发生银镜反应。
(1)(5分)某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。
试求:
①该有机物的最简式。
②若符合该最简式的A物质可能不止一种,则它们之间的关系(填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发
生酯化反应,且所有碳原子在同一链上,则A的结构简式为。
(2)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知: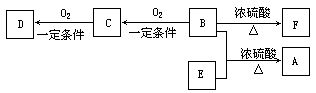
ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。ⅲ.D、E互为具有相同官能团的同分异构体。E
分子烃基上的氢若被Cl取代,其一氯代物只有一种。ⅳ.F可以使溴的四氯化碳溶液褪色。
① B可以发生的反应有(选填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.氧化反应
② D、F分子所含的官能团的名称依次是、。
③写出与D、E具有相同官能团的一种同分异构体的结构简式__________________。
④写出B和E反应生成A的化学方程式是:。
⑤写出C与银氨溶液反应的化学方程式:。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ |
Na+ |
Cu2+ |
Al3+ |
| 阴离子 |
SO42- |
HCO3- |
NO3- |
OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B,D。
(2)写出A溶液与E溶液反应的离子方程式:。
(3)C常用作净水剂,用离子方程式表示其净水原理。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为。
(5)向C溶液中加入过量E溶液,反应的离子方程式为。
(6)向100mL 1.0mol/LC溶液中加入1.0mol/LE溶液,若要使生成沉淀质量最大,则加入E的体积为mL。
(15分)1、下列有关元素锗及其化合物的叙述中正确的是___________
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |
2、铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g·cm-3,则阿伏加德罗常数为(列式计算);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方应程式为。
镇痉药物C,化合物N以及高分子树脂(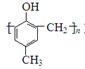 )的合成路线如下:
)的合成路线如下: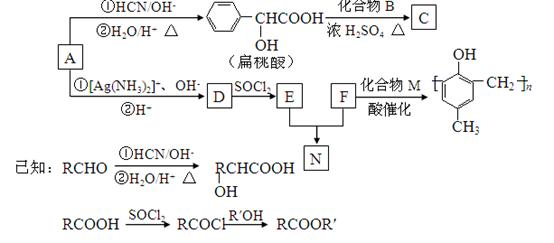
(1)A的含氧官能团的名称是。
(2)A在催化剂作用可与H2反应生成B,该反应的反应类型是。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是。
(4)A发生银镜反应的化学方程式是。
(5)扁桃酸(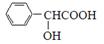 )有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体有种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式______________。
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体有种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式______________。
(6)N在NaOH溶液中发生水解反应的化学方程式是。