电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: 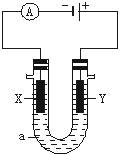
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为_______________。在X极附近观察到的现象是________________。
②Y电极上的电极反应式为_________________,检验该电极反应产物的方法是___________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是__________,电极反应式为________________。
②Y电极的材料是__________,电极反应式为_______________。(说明:杂质发生的电极反应不必写出)
传统中药的砷剂俗称“砒霜”,请回答下列问题:
(1)砷剂的分子结构如图所示。该化合物中As原子的杂化方式为______。
(2)基态砷原子的价层电子排布式为___________________,砷与硒的第一电离能较大的是__________。
(3)已知: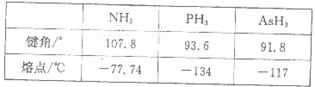
依据表中数据解释NH3熔点最高的原因____________________。
(4)砷酸(H3AsO4)是一种三元中强酸,根据价层电子对互斥理论推测AsO43-的空间构型为____________________。
(5)砷镍合金的晶胞如图所示,该晶体中与每个Ni原子距离最近的As原子有______个。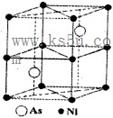
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):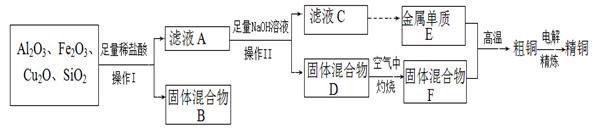
已知:Cu2O + 2H+=" Cu" + Cu2+ + H2O。
(1)滤液A中铁元素的可能存在形式为_______(填离子符号),与之相关的离子方程式为_____________,若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为_____________________________。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是_________(填代号)。
a.若用硫酸铜溶液作电解液,SO2- 4向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是和。
②T元素最可能是(填“s”“P” “d”或“ds”等)区元素,位于族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为,其中心原子的杂化方式为。
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1)Zn2+在基态时核外电子排布式为_____。
(2)SO42-的空间构型是_____(用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3、CH2="CH-CHO," HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是_____(不定项选择)。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1mo1PAN中含σ键数目为_____。
③NO能被FeS04溶液吸收生成配合物[(Fe(NO)(H20)5)S04,该配合物中心离子的配位数为_____(填数字)。
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=_____(填数字)。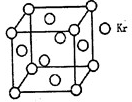
铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s)ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为。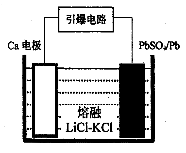
(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为。
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。

①常温下,pH=6→7时,铅形态间转化的离子方程式为。
②用活性炭处理,铅的去除率较高时,铅主要应该处于(填铅的一种形态的化学式)形态。